Tableau périodique des éléments
I
II
III
IV
V
VI
VII
1
2
3 4 5 6 7 8 9 10 11 12
13 14 15 16 17
18
SEL
1
H
Hydrogène
2
He
Hélium
La
57
Ac
89
NeFO
NéonFluorOxygène
6 7 8 9 10
CN
AzoteCarbone
B
5
Bore
ArClS
ArgonChloreSoufre
14 15 16 17 18
Si P
PhosphoreSilicium
Al
13
Aluminium
Lanthane
Actinium
Li
3
Be
4
Lithium Bérylium
11
Mg
12
Na
Sodium Magnésium
Potassium
19
Ca
20
37
Sr
38
55
Ba
56
87
Ra
88
K
Rb
Cs
Fr
Calcium
Rubidium Strontium
Césium Baryum
Francium Radium
Ti
22
Zr
40
Hf
72
104
Titane
V
23
Vanodium
Cr
24
Chrome
Mn
25
Manganèse
Fe
26
Fer
Co
27
Cobalt
Ni
28
Nickel
Cu
29
Cuivre
Zn
30
Zinc
Nb
41
Niobium
Mo
42
Molybdène
Tc
43
Technétium
Ru
44
Ruthénium
Rh
45
Rhodium
Pd
46
Palladium
Ag
47
Argent
Cd
48
Cadmium
Ga
31
Gallium
Ge
32
Germanium
As
33
Arsenic
Se
34
Sélénium
Br
35
Brome
Kr
36
Krypton
In
49
Indium
Sn
50
Etain
Sb
51
Antimoine
Te
52
Tellure
I
53
Iode
Xe
54
Xénon
Ta
73
Tantale
W
74
Tungstène
Re
75
Rhénium
Os
76
Osmium
Ir
77
Iridium
Pt
78
Platine
Au
79
Or
Hg
80
Mercure
Tl
81
Thallium
Pb
82
Plomb
Bi
83
Bismuth
Po
84
Polonium
At
85
Astate
Rn
86
Radon
105
Dubnium
106
Seaborgium
107
Bohrium
108
Hassium
109
Meitnerium
110
Darmstadtium
111
Roentgenium
112
Copernicium
113
Nihomium
114
Flerovium
115
Moscovium
116
Livermorium
117
Tennessine
118
Oganesson
Ce
58
Cérium
Pr
59
Praséodyme
Nd
60
Néodyme
61
Prométhium
Sm
62
Samarium
Eu
63
Europium
Gd
64
Gadolinium
Tb
65
Terbium
Dy
66
Dysprosium
Ho
67
Holmium
Er
68
Erbium
Tm
69
Thulium
Yb
70
Ytterbium
Lu
71
Lutetium
Th
90
Thorium
Pa
91
Protactinium
U
92
Uranium
93
Neptunium
94
Plutonium
95
Américium
96
Curium
97
Berkzlium
98
Californium
99
Einsteinium
100
Fermium
101
Mendelevium
102
Nobelium
Rf Db Sg Bh Hs Mt Ds Rg Cn Nh Fi Mc Lv Ts Og
Pm
PuNp Am Cm Bk Cf Es Fm Md No Lr
103
Lawrencium
Zirconium
Hafnium
Rutherfordium
Sc
21
Y
39
La-Lu
57-71
Ac-Lr
89-103
Scandium
Yttrium
Lanthanides
Actinides
Le tableau de Mendeleïev
PRINCIPE
Conçu en 1869 par le chimiste russe Dimitri Ivanovitch
Mendeleiev, le tableau périodique classe tous les éléments
chimiques selon leur numéro atomique et leurs propriétés
chimiques. Quatre éléments ont été identifiés entre 2004
et 2010 et viennent d’être validés par l’Union internationale
de chimie pure et appliquée (IUPAC).
Les défis du CEA
Octobre 2016
N°211
Aude Ganier, Claire Abou et Michel Szlazac (infographie), avec la collaboration de Pascal Reiller, chercheur à la DEN
Atome
Constituant fondamental
de la matière formé par un noyau
(au centre), composé de protons
et de neutrons, autour duquel
se répartissent des électrons en diérents
niveaux d’éneries appelés couches
électroniques (ellipses).
Les atomes stables connus ont jusqu’à
7 couches électroniques (correspondant
aux 7 lines du tableau) dont les électrons
occupent au fur et à mesure des orbitales
électroniques (il existe jusqu’à 44 types
de ces orbitales pouvant contenir des sous-
couches électroniques : s(1), p(3), d(5) et f (7)).
Élément chimique
Ensemble des atomes caractérisés
par un nombre défini de protons
dans leur noyau. Ces atomes ont
diérentes formes possibles :
les isotopes (même nombre de protons et
d’électrons mais nombre diérent de neutrons).
Numéro atomique : nombre de protons
et d’électrons de l’élément
Symbole atomique : représentation universelle
de l’élément
Périodes (I à VII)
Classement des éléments selon leur
confiuration électronique (pour prévoir
l’évolution de leurs propriétés) : nombre
d’orbitales occupées par des électrons.
Les éléments de la line I ont
1 couche occupée, ceux de la line II
en ont 2, etc.
Groupes (1 à 18)
Oranisation des éléments selon leurs
propriétés communes, comme la réactivité
(capacité de l’élément à céder ou recevoir
des électrons).
Colonnes 1, 2 et 13 à 17 : éléments remplissant
proressivement les orbitales « s » et « p »
et ayant le même nombre d’électrons sur leur
couche électronique : col. 1 = 1 électron,
col. 13 = 3 électrons, col. 14 = 4, etc.
Colonnes 3 à 12 : éléments remplissant
les orbitales « d » et « f ».
Colonne 18 : éléments dont la couche
électronique externe est saturée.
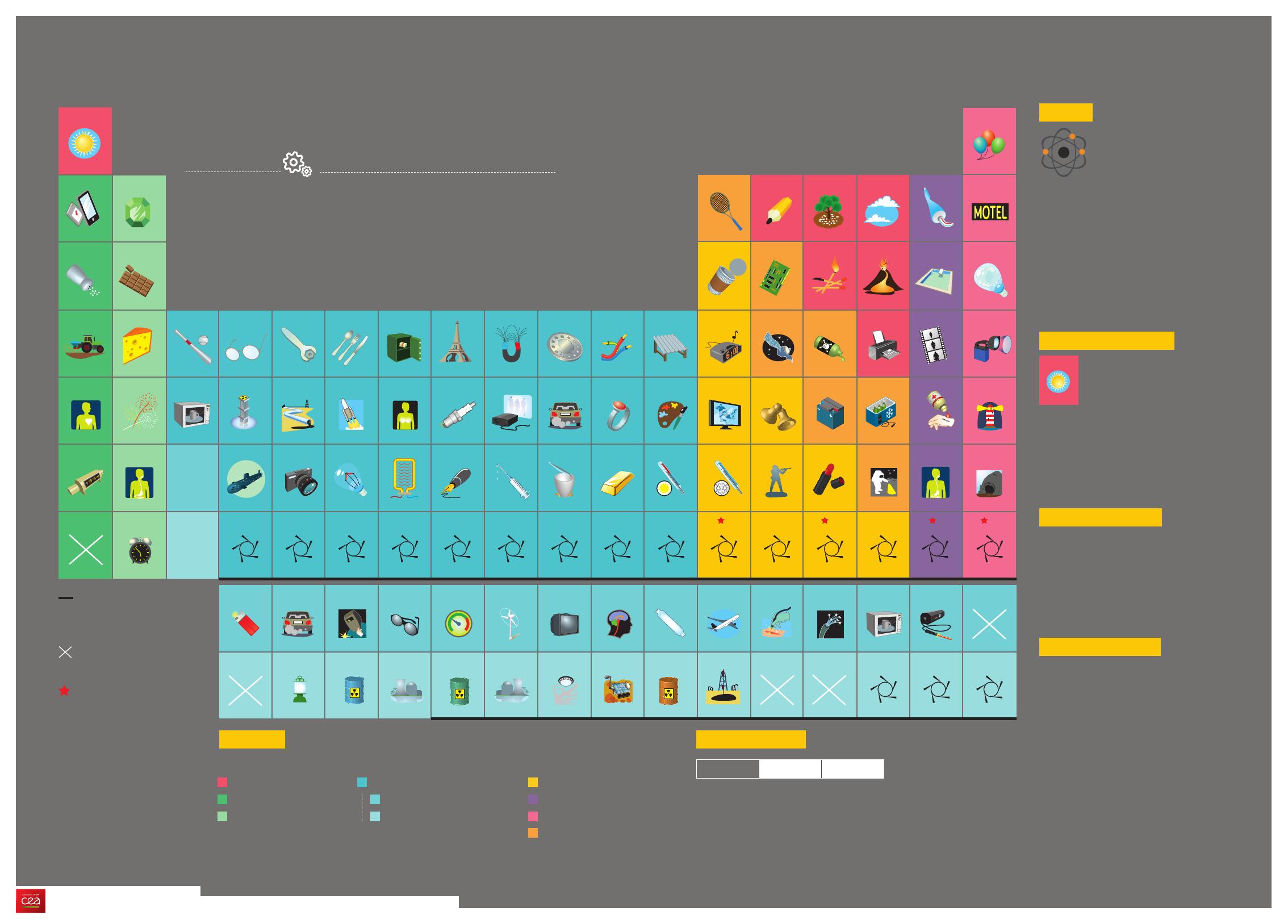
Non-métaux
Métaux alcalins
Métaux alcalino-terreux
Métaux de transition
Lanthanides (ou terres rares)
Actinides
Métaux pauvres
Haloènes
Gaz rares
Métalloïdes
Nouveaux éléments
chimiques validés en 2016
par l’IUPAC
État physiques
Ne az Hg liquide Fe solide
Éléments synthétiques
créés artificiellement dans
des accélérateurs de particules
ou lors de réactions nucléaires
1
H
Hydrogène
Familles
Classement des éléments en fonction d’un comportement chimique proche.
Éléments n’ayant pas
d’utilisation

Le tableau
de Mendeleïev
I
II
III
IV
V
VI
VII
1
2
3 4 5 6 7 8 9 10 11 12
13 14 15 16 17
18
SEL
1
H
Hydrogène
2
He
Hélium
La
57
Ac
89
NeFO
NéonFluorOxygène
6 7 8 9 10
CN
AzoteCarbone
B
5
Bore
ArClS
ArgonChloreSoufre
14 15 16 17 18
Si P
PhosphoreSilicium
Al
13
Aluminium
Lanthane
Actinium
Li
3
Be
4
Lithium Bérylium
11
Mg
12
Na
Sodium Magnésium
Potassium
19
Ca
20
37
Sr
38
55
Ba
56
87
Ra
88
K
Rb
Cs
Fr
Calcium
Rubidium Strontium
Césium Baryum
Francium Radium
Ti
22
Zr
40
Hf
72
104
Titane
V
23
Vanodium
Cr
24
Chrome
Mn
25
Manganèse
Fe
26
Fer
Co
27
Cobalt
Ni
28
Nickel
Cu
29
Cuivre
Zn
30
Zinc
Nb
41
Niobium
Mo
42
Molybdène
Tc
43
Technétium
Ru
44
Ruthénium
Rh
45
Rhodium
Pd
46
Palladium
Ag
47
Argent
Cd
48
Cadmium
Ga
31
Gallium
Ge
32
Germanium
As
33
Arsenic
Se
34
Sélénium
Br
35
Brome
Kr
36
Krypton
In
49
Indium
Sn
50
Etain
Sb
51
Antimoine
Te
52
Tellure
I
53
Iode
Xe
54
Xénon
Ta
73
Tantale
W
74
Tungstène
Re
75
Rhénium
Os
76
Osmium
Ir
77
Iridium
Pt
78
Platine
Au
79
Or
Hg
80
Mercure
Tl
81
Thallium
Pb
82
Plomb
Bi
83
Bismuth
Po
84
Polonium
At
85
Astate
Rn
86
Radon
105
Dubnium
106
Seaborgium
107
Bohrium
108
Hassium
109
Meitnerium
110
Darmstadtium
111
Roentgenium
112
Copernicium
113
Nihomium
114
Flerovium
115
Moscovium
116
Livermorium
117
Tennessine
118
Oganesson
Ce
58
Cérium
Pr
59
Praséodyme
Nd
60
Néodyme
61
Prométhium
Sm
62
Samarium
Eu
63
Europium
Gd
64
Gadolinium
Tb
65
Terbium
Dy
66
Dysprosium
Ho
67
Holmium
Er
68
Erbium
Tm
69
Thulium
Yb
70
Ytterbium
Lu
71
Lutetium
Th
90
Thorium
Pa
91
Protactinium
U
92
Uranium
93
Neptunium
94
Plutonium
95
Américium
96
Curium
97
Berkzlium
98
Californium
99
Einsteinium
100
Fermium
101
Mendelevium
102
Nobelium
Rf Db Sg Bh Hs Mt Ds Rg Cn Nh Fi Mc Lv Ts Og
Pm
PuNp Am Cm Bk Cf Es Fm Md No Lr
103
Lawrencium
Zirconium
Hafnium
Rutherfordium
Sc
21
Y
39
La-Lu
57-71
Ac-Lr
89-103
Scandium
Yttrium
Lanthanides
Actinides
TOUT
S’EXPLIQUE
211
ENJEU
« Une merveille de l’esprit humain », c’est en
ces termes que le Tableau de Mendeleïev est
décrit par la communauté scientifique. Pour
cause, lorsque Dimitri Mendeleïev établit le
classement des éléments chimiques en 1869,
ni l’électron, ni même la structure de l’atome ne
sont découverts. Joseph John Thomson prouvera
expérimentalement l’existence du premier en
1897 ; et Ernest Rutherford (par ailleurs élève de
Thomson) découvrira le noyau atomique en 1911.
Visionnaire, Mendeleïev constate à l’époque une
« périodicité » des propriétés chimiques des
éléments, à partir de leur masse, qui lui permet
d’en classer 63 dans ce « Tableau périodique
des éléments ». La découverte de l’électron
donnera raison à l’intuition du chimiste car la
périodicité correspond en eet à une « période »
de remplissae des couches électroniques les
unes après les autres, conférant des propriétés
chimiques plus ou moins semblables aux
éléments. Cette périodicité a permis de construire
proressivement et en toute cohérence le tableau
qui porte désormais le nom de son inventeur.
En 2010, il comptait 109 éléments. L’Union
internationale de chimie pure et appliquée (IUPAC)
valide en 2016 quatre nouveaux candidats,
portant à 118 le nombre d’éléments du Tableau de
Mendeleïev, devenu incontournable pour anticiper
les propriétés chimiques et faire proresser les
connaissances.
© iStock
TOUT
S’EXPLIQUE
www.grouperougevif.fr
Il classe les éléments chimiques en fonction de leur masse
et numéro atomique, configuration électronique et propriétés
chimiques : le tableau de Mendeleïev est la référence ultime
des éléments présents sur Terre, dans les étoiles ou les accélérateurs.
Il se dote aujourd’hui de quatre nouvelles recrues.
Histoire d’une découverte qui en promet d’autres…
Nihonium (Nh), moscovium (Mc), tennessine (Ts) et oanes-
son (O) : ces éléments superlourds font ociellement
partie du tableau de Mendeleïev depuis 2015 et l’Union inter-
nationale de chimie pure et appliquée (IUPAC) a dévoilé leurs
dénominations en 2016.
L’élément 113 a été découvert par Kosuke Morita au centre
Riken Nishina à Wapo. Il porte le nom « nihonium », en réfé-
rence au mot « nihon » sinifiant Japon, car il s’ait du pre-
mier élément à être nommé en Asie de l’Est.
Découverts par une collaboration reroupant le JNR à Moscou
et des centres de recherche du Tennessee, les éléments 115
et 117 portent ainsi les noms « moscovium » et « tenessine ».
L’élément 118 « oanesson» est une référence à son inven-
teur Yuri Oanessian, chercheur du JNR.
Les quatre
nouveaux éléments
Les chimistes n’en sont pas moins des mélomanes,
tout enre confondu ! La découverte de l’élément 115
a motivé une pétition internationale pour que le nom
Lemmium lui soit attribué ; et ce, en l’honneur du chan-
teur Lemmy Kilmister du célèbre roupe de Heavy Metal,
Motörhead, disparu en 2015.
Malré les 45 000 sinatures recueillies, l’IUPAC n’a pas
déroé à ses rèles : les nouveaux éléments peuvent
prendre le nom de l’une de leurs propriétés physiques
ou chimiques, d’un concept, d’un personnae mytholo-
ique, d’un minerai, d’une réion éoraphique ou d’un
scientifique.
Quant au symbole atomique, il est composé d’une
majuscule suivie d’une minuscule et correspond à la
traduction du nom de l’élément en français, anlais,
allemand ou latin.
Anecdote
Des éléments « naturels » et « artificiels »
Le Tableau de Mendeleïev recense les éléments chimiques
connus. Certains finiront par disparaître à l’échelle du temps
éoloique de la Terre comme l’uranium (élément 92), métal
lourd radioactif à la demi-vie (temps nécessaire pour que
la moitié des noyaux d’un élément se désintèrent naturel-
lement) très lonue d’environ 4,46 milliards d’années pour
l’uranium 238 et 703,8 millions d’années pour l’uranium
235. D’autres éléments ont déjà disparu, par exemple les
actinides 93 à 103 : curium, américium, plutonium. Précisons
que le 239Pu « naturel » n’est présent qu’à l’état de traces
(1 atome de plutonium sur 10
23
atomes) dans la couche
terrestre, ce qui le rend insinifiant ; découvert en 1940,
il est surtout considéré comme un élément synthétique,
ou « artificiel », car créé principalement dans les réacteurs
nucléaires.
Les derniers éléments du tableau de Mendeleïev
sont exclusivement « artificiels ». Einsteinium (99)
et Fermium (100), ont été découverts en 1952 lors
de l’opération américaine Mike (première bombe H).
Quant aux « quatre nouveaux », ils résultent d’expé-
riences conduites dans des accélérateurs de parti-
cules. Ces artefacts ne devraient pas être les derniers,
tant la matière se révèle riche dans ces incroyables
instruments.
1
/
2
100%