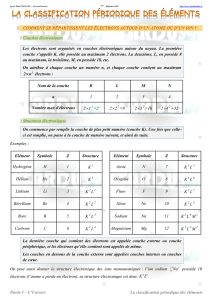
1. La première classification périodique des éléments

Seconde 582691317 page 1 / 4
Ch 2.2 LA CLASSIFICATION PERIODIQUE DES ELEMENTS
1. LA PREMIERE CLASSIFICATION PERIODIQUE DES ELEMENTS
Avant 1700, seuls 12 corps simples avaient été isolés ; en 1850, on en connaissait 61 !
L'étude des propriétés des corps simples connus permit la mise en évidence d'analogies : ainsi, en 1808, H. Davy
montra que le calcium, le strontium et le baryum avaient des propriétés voisines.
La définition d'un système de masses atomiques (masse des atomes) vers 1860 offrit un critère quantitatif de
classement des corps simples.
En 1869, un professeur russe, Dimitri Mendeleïev classe les éléments par ordre de masse atomique croissante et
rassemble dans une même colonne les éléments possédant des propriétés voisines.
Questions et travail à effectuer :(en s’aidant du texte ci-dessus et des connaissances du chapitre précédent)
1. A l’époque de Mendeleïev,
parlait-on d’atomes ?……………….
connaissait-on les électrons ? Le numéro atomique ?………………
2. Travail à effectuer :
Sortir les cartes des éléments de l'enveloppe et constituer 8 groupes de plusieurs éléments ayant les mêmes
propriétés en utilisant les propriétés des corps simples et les formules des corps composés.
3. Quel fut le premier critère quantitatif permettant une classification des éléments ?…………………….
4. Mendeleïev classe les éléments en plaçant :
sur une même ligne les éléments par ordre de ……………… ……………… croissante.
sur une même colonne les éléments qui ont les mêmes ………………………………
5. Application :
Essayer de retrouver une partie de la classification périodique en utilisant la même méthode que Mendeleïev.
Placer les cartes de façon à respecter les deux critères de Mendeleïev, puis remplir les cases du tableau 1 par le
symbole et le nom de chaque élément. ( il peut y avoir des cases vides ! )
Tableau 1
Remarque : en réalité, Mendeleïev avait inversé les lignes et les colonnes…. Voir livre doc1 p 248
2. REPARTITION DES ELECTRONS D’UN ATOME
Le nuage électronique
2.1.1. Les couches électroniques :
Tous les électrons sont …….
Mais ils ne sont pas tous liés de la même façon au noyau.
Exemple :
Les électrons sont répartis en différentes couches, que l’on représente par des numéros ( 1, 2, 3…) ou notées K,
L, M … de plus en plus éloignées du noyau.

Seconde 582691317 page 2 / 4
2.1.2. Règles de remplissage de Pauli ( 1900 - 1958 ) :
Les couches électroniques contiennent un nombre ……………d’électrons
La couche K contient …….électrons
La couche L contient ……..électrons
La couche M contient …….électrons
Des électrons remplissent d’abord la couche..…, puis quand elle est …..…….., la couche …., etc.
La couche la plus éloignée du noyau est appelée …………… ……..…. : elle contient les électrons les ……….
liés au noyau.
2.1.3. Application :
Remplir le tableau suivant en notant la structure électronique ( ou modèle électronique ) sous la forme :
( K )x ( L )y ( M )z x, y, et z étant les nombres d'électrons dans les différentes couches d'un atome dans son état
fondamental.
Tableau 2
Elément
Béryllium
Bore
Symbole (Z)
1H
2He
3Li
4Be
5B
6C
7N
Structure
électronique
Elément
Néon
Symbole (Z)
8O
9F
10Ne
11Na
12Mg
13Al
14Si
Structure
électronique
Elément
Phosphore
Argon
Symbole (Z)
15P
16S
17Cl
18Ar
Structure
électronique
Classification périodique actuelle
A partir des tableaux 1 et 2, compléter le tableau 3 en vous inspirant de l’exemple donné, et, en indiquant
uniquement la structure de la couche externe.
Tableau 3 :
1H
(K)1
Conclusions.
Les éléments sont classés par …………………… ....………………… (……) croissant.
Les éléments d'une même …………………… ont le même nombre d' …………………… sur la couche
……………………
Chaque ligne du tableau correspond au remplissage d'une nouvelle ………………… .

Seconde 582691317 page 3 / 4
3. COMPORTEMENT CHIMIQUE D'UNE FAMILLE D'ELEMENTS : LES HALOGENES (Tp cours)
Les éléments de l'avant - dernière colonne de la classification périodique forment la famille des halogènes :
F ( fluor ) ; Cl ( chlore ) ; Br ( brome ) ; I ( iode ) ; At ( astate ).
Le but de ce TP est de comparer quelques propriétés chimiques de trois de ces halogènes : Cl, Br et I qui se
présentent sous forme d'atomes dans les molécules Cl2, Br2 et I2 ( dihalogènes ) et sous forme d'ions (
halogènures ) dans les composés ioniques.
3.1. Réactions chimiques avec les dihalogènes
3.1.1. Présentation des dihalogènes :
Les dihalogènes : Cl2 : …………… , Br2 : …………… et I2 : …………… sont des corps …………… .
Ce sont des espèces chimiques très toxiques donc dangereuses.
A température ambiante, Cl2 est un …………… de couleur …………… , Br2 est un …………… et I2 est un
…………… .
3.1.2. Réaction avec le fer :
Agiter.
Observations : Observations :
Equation-bilan de la réaction :
Agiter.
Observations : Observations :
Equation-bilan de la réaction :
Agiter.
Observations : Observations :
Equation-bilan de la réaction :
3.1.3. Conclusion :
+ solution de soude : …………
+ fer en limaille
Eau de chlore
de couleur :
…………………
.
+ solution de soude : …………
+ fer en limaille
Eau de brome
de couleur :
…………………
.
+ solution de soude : …………
+ fer en limaille
Eau iodée
de couleur :
…………………
.

Seconde 582691317 page 4 / 4
3.2. Réactions chimiques avec les ions halogènures :
3.2.1. Présentation des halogènures :
Les halogènures de potassium ( KCl, KBr et KI ) sont des solides non toxiques, solubles dans
l'eau et donnant des solutions incolores.
3.2.2. Réaction avec les ions argent : Ag + :
Observation : Observation : Observation :
Ag + + …… …………… Ag + + …… …………… Ag + + ……
……………
Remarque :
3.2.3. Réaction avec les ions plomb : Pb 2+ :
Observation : Observation : Observation :
Pb 2+ + …… …………… Pb 2+ + …… …………… Pb 2+ + ……
……………
3.2.4. Conclusion :
3.3. Conclusion générale
+ quelques gouttes de solution de nitrate d'argent ………….
solution de
chlorure de
potassium :
solution de
bromure de
potassium :
solution
d'iodure
potassium :
+ quelques gouttes de solution de nitrate de plomb ………….
solution de
chlorure de
potassium :
solution de
bromure de
potassium :
solution
d'iodure
potassium :
1
/
4
100%