TP : La classification périodique des éléments But de l`activité

Thème : Univers
Chap. : Chimie de la Terre
TP : La classification périodique des éléments
2nde
But de l’activité : Comprendre la classification des éléments.
Partie I : La classification selon Mendeleïev
Document 1 : Mendeleïev et les éléments chimiques
L'année 1860 voit s'ouvrir à Karlsruhe (en Allemagne) le premier congrès International de Chimie.
On ne connaît, à l'époque, que 63 éléments. Leurs propriétés physiques et chimiques sont dans
l'ensemble assez bien décrites, mais leurs masses atomiques (masse d'un nombre défini d’atomes)
sont souvent floues, voire méconnues, et cela malgré les remarquables travaux d'analyse des
chimistes suédois Berzelius et italien Avogadro. Bref, la chimie est à la fois en pleine expansion et
en plein désordre.
L'idée est cependant dans l'air que, si l'on classe les éléments par masses atomiques croissantes,
on doit pouvoir observer une certaine périodicité dans leurs propriétés.
En 1867, Mendeleïev est professeur de Chimie minérale à l'université de Saint Pétersbourg, et
depuis plusieurs années, il prépare des fiches pour chaque élément où il indique sa masse atomique (molaires) et les
formules des principales combinaisons chimiques auxquelles il participe.
En les rangeant par masses atomiques croissantes, il est frappé par une évolution régulière de leurs propriétés, mais
surtout par le fait qu'à intervalles fixes, celles-ci se répètent par séquences successives. D'où l'idée de construire un
tableau.
Document 2 : La classification de Mendeleïev

1. Quels sont les deux critères qui ont permis à Mendeleïev de classer les éléments et d’établir une
périodicité.
2. Quel critère ont les atomes d’une même colonne en commun ? Donner un ou deux exemples.
Partie II : La classification actuelle
Afin de satisfaire à la règle du duet ou de l’octet (et donc d’obtenir une couche externe complète), les atomes forment
des liaisons entre eux, en « partageant » leurs électrons (soit en en donnant, soit en en acceptant – tout dépend de ce
qui est le plus facile). Ce sont les liaisons covalentes.
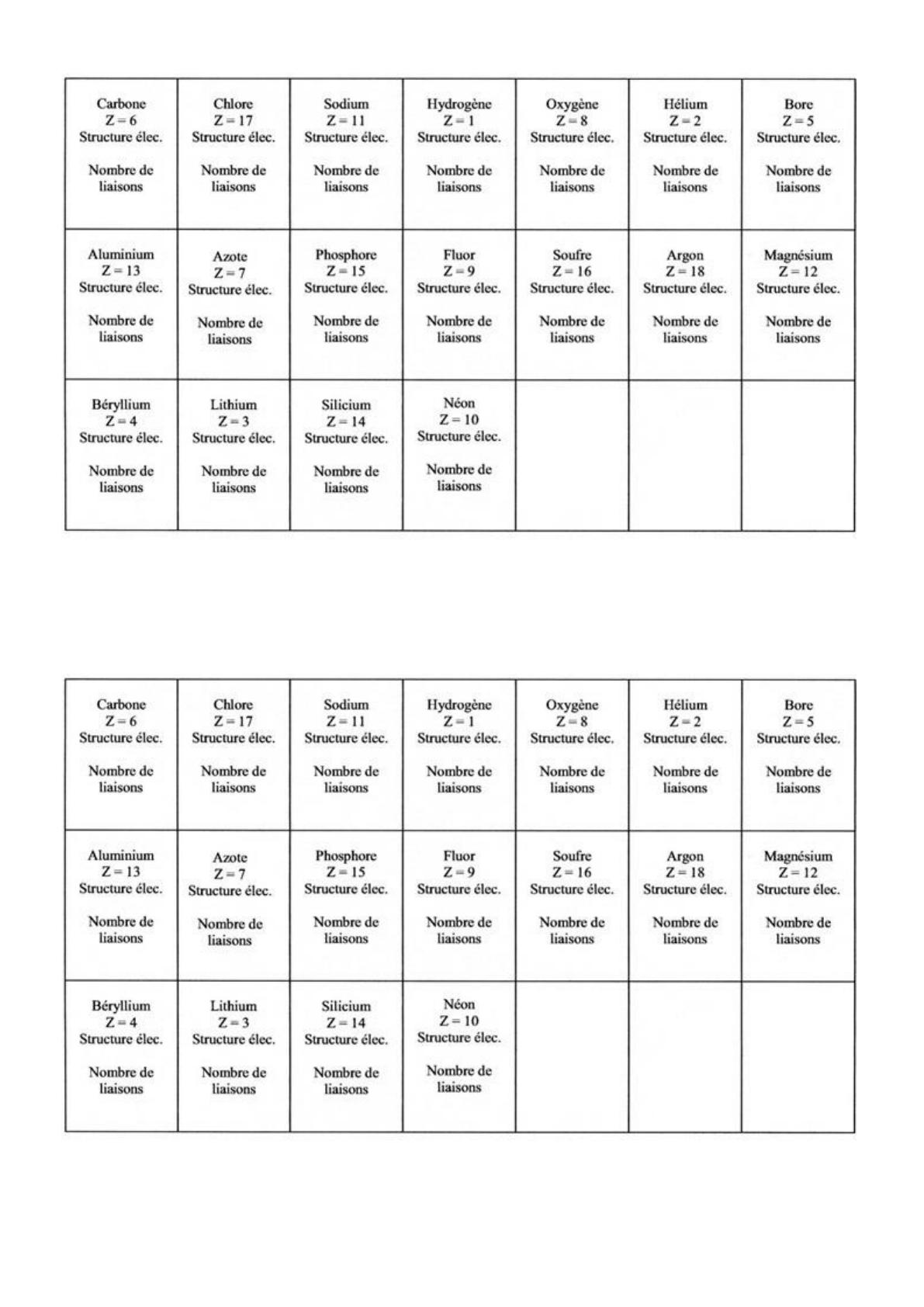
3. Compléter le tableau ci-dessous en donnant la structure électronique de chaque atome et en déterminant
combien de liaisons covalentes il peut former.
Nom de l’atome
(Symbole)
Numéro
atomique
Z
Structure électronique
Nombre de
liaisons possibles
Aluminium (Al)
13
Argon (Ar)
18
Azote (N)
7
Béryllium (Be)
4
Bore (B)
5
Carbone (C)
6
Chlore (Cl)
17
Fluor (F)
9
Hélium (He)
2
Hydrogène (H)
1
Lithium (Li)
3
Magnésium (Mg)
12
Néon (Ne)
10
Oxygène (O)
8
Phosphore (P)
15
Silicium (Si)
14
Sodium (Na)
11
Soufre (S)
16
Vous disposez de «cartes » représentant le symbole de l’élément, son nom et le numéro atomique
A partir du tableau, recopier sur chaque CARTE :
La structure électronique des atomes
Le nombre de liaisons covalentes qu’il doit former pour satisfaire à la règle du duet ou de l’octet.
Découper ensuite ces cartes afin d'en faire un jeu de 18 cartes.
4. Etablir un classement par numéro atomique croissant.
Reprendre ce classement et le réorganiser à partir du nombre d’électrons sur la couche externe.
Coller ce classement sur le compte-rendu et indiquez le nombre d’électrons sur la couche externe au bas de
chaque colonne.
Conclusion
En comparant les deux classements finaux obtenus précédemment, répondre aux questions suivantes.
5. Que peut-on dire pour les éléments d’une même colonne ?
6. Que peut-on en déduire sur les propriétés chimiques des éléments d’une même colonne ?
7. A quoi correspond un changement de ligne ?
8. Que peut-on dire sur les éléments d’une même ligne ?
Pour en savoir plus
Conseil à tous ceux possédant un Smartphone ou une tablette, télécharger l’application gratuite Merck PTE HD (Google Play Store) ou Merck
PSE HD (App Store), qui est un tableau périodique interactif très complet (image des éléments, date de découvertes…)
1
/
3
100%