1 CHAPITRE II : STRUCTURE DE L`ATOME Dr. L. HAMMAL I. L

1
CHAPITRE II : STRUCTURE DE L’ATOME
Dr. L. HAMMAL
I. L'atome.
1. Notion de modèle.
En sciences physiques, un modèle est une représentation de la réalité. Ce n'est donc pas la
réalité. Cette représentation est élaborée progressivement à partir des observations.
Un modèle doit posséder deux vertus:
Permettre d'expliquer les propriétés observées,
Permettre de prévoir d'autres propriétés non encore observées.
Un modèle est en permanente évolution puisque de nouvelles découvertes sont
susceptibles de le mettre en défaut. Enfin et paradoxalement c'est souvent l'étude des
défauts d'un modèle qui permet d'approfondir nos connaissances en sciences physiques.
2. Modèle de l'atome.
A l'heure actuelle les physiciens et les chimistes pensent q'un atome peut être modélisé
par une structure présentant un noyau autour duquel existe une zone sphérique centrée sur
le noyau et dans laquelle il y a une certaine probabilité de trouver les électrons. Cette
partie de l'atome est appelée nuage électronique. On donne ci-contre un dessin d'un
modèle probabiliste d'un atome d'hydrogène composé d'un noyau et d'un unique électron.
3. Le noyau de l'atome.
a. Les nucléons
Le noyau de l'atome est constitué de deux types de particules, les nucléons dont certaines
propriétés sont regroupés dans le tableau ci-dessous:

2
Nom Charge Masse
Proton e 1,6.10 -19Cmp1,00767uma 1,67265 x10–27 kg
Neutron 0mn1,00887uma 1,67 496 x10– 27 kg
Il faut mémoriser que la charge électrique portée par le proton est notée eet appelée:
charge élémentaire. C'est la plus petite charge électrique stable que l'on puisse isoler.
b. Les nombres Z et A.
Le nombre de charge ou numéro atomique Zd'un noyau est le nombre de protons qu'il
contient.
Areprésente le nombre de nucléons du noyau.
On convient de représenter le noyau d'un atome par le symbole:
Dans ce symbole, X représente un élément. Par exemple O: oxygène, Cl: chlore, N: azote.
Si l'on note N le nombre de neutrons du noyau on a: A=Z+N.
4. Le nuage électronique.
On appelle ainsi la zone sphérique de l'espace, centrée sur le noyau, dans laquelle il y a
une certaine probabilité de trouver, à un instant donné, le (ou les) électron(s) de l'atome.
certaines propriétés de l'électron sont données ci-dessous:
Charge Masse
Electron –e –1,6.10
-
19Cme9,1.10
-
31kg
Il n'est pas nécessaire de retenir la valeur de la masse de l'électron. Par contre il est utile
de savoir que cette masse est beaucoup plus petite que celle d'un nucléon (environ 2000
fois plus petite) ce qui nous autorise à négliger la masse des électrons devant celle des
nucléons.
meest négligeable devant mpou mn.
L'unité de masse atomique :

3
Cette unité de masse adaptée à l'étude des objets microscopique est définie comme étant le
douzième de la masse de l'atome de carbone.
Une mole de carbone pesant par convention 12 g et correspondant à N atomes de carbone, un
atome de carbone pèse donc 12 / N g et l'unité de masse atomique vaut donc 1 / N g.
1 u.m.a = 1 / N g = 1 / 6,022 1023 » 1,67 10-24 g » 1,6710-27 kg
Comme nous l'avons vu plus haut la masse du proton (ou celle du neutron) est justement
pratiquement égale à cette masse de 1,67 10-27 kg.
Mp = mn = 1 u.m.a
Influence de la composition de l'atome
En première approximation (qui suffit au chimiste), un atome est composé de trois particules :
électrons, protons, neutrons...
Si le nombre de neutrons (n) varie les propriétés chimiques ne changent pas, seule la
stabilité du noyau est remise en question : instabilité radioactive).
Si le nombre de protons (p) varie, on change d'élément chimique.
Si le nombre d'électrons (e-) varie, on garde le même élément chimique mais cet élément
se trouve sous différentes formes ioniques.
Isotopie :
Les isotopes d’un élément sont des nucléides possédant le même numéro atomique et un
nombre de masse différent (nombre de neutrons différent).
La plupart des éléments naturels à l’état de corps simples sont constitués d’un mélange
d’isotopes.
Ex : Le carbone possède deux isotopes stables dans la nature, 12C (98,89 %) et 13C
(1,11 %).
L'abondance relative des différents isotopes
On désigne par abondance naturelle le pourcentage en nombre d'atomes de chacun des
isotopes présents dans le mélange naturel. Cette abondance est équivalente à la fraction
molaire de chaque isotope stable.
La Masse Molaire de l'élément :
M = xi Mi
Exp :
MC = 0,9889 * M(12C) + 0,011* (M13C)
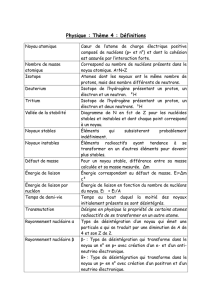
4)- Stabilité des noyaux.
Parmi la centaine d'éléments connus seul les 83 premiers (à l'exception du Technétium (Z=43)
et du Prométhium (Z=61) possèdent au moins un isotope stable. A partir du Polonium (Z=84)
il n'existe plus de nucléides stables, ils sont tous radioactifs.
Pour les premiers éléments de Z < 30 on constate que les isotopes stables contiennent un
nombre de neutrons sensiblement égal à celui des protons. Z = N. Au delà de Z = 30 les
isotopes stables contiennent un nombre de neutrons plus élevé que celui des protons : N > Z.
Diagramme de stabilité des isotopes( Fig 1) et fig 2.

4
On peut expliquer simplement ce fait en considérant que les protons chargés positivement se
repoussent, l'ajout de neutrons stabilise les nucléides par un effet de
"dilution" des charges positives qui en étant plus éloignées les unes des autres auront tendance
à moins se repousser. Plus le nombre de protons augmente et plus le nombre de neutrons
devra augmenter pour que le nucléide soit stable. Si le nombre de protons devient trop élevé
(Z >84) cet effet de « dilution des charges » devient inefficace et il n’existe plus de noyaux
stables.
Energie de cohésion des noyaux - Energie Nucléaire
Nous avons signalé précédemment l'existences des forces nucléaires (forte et faible) qui
s'opposant à la force de Coulomb étaient responsables de la stabilité (ou de la cohésion) du

5
noyau. A ces forces sont associée une énergie appelée énergie de cohésion (ou parfois énergie
de liaison) du noyau.Le noyau est plus stable que ses éléments (protons et neutrons) séparés,
lors de la formation du noyau, il y a donc libération d'énergie.
D'après la relation d'Einstein d'équivalence Masse - Energie
E = m C2
À cette énergie correspond une masse. En d’autres termes lors de la formation du noyau à
partir de ces éléments séparés une partie de la masse des particules est transformée en énergie.
La masse du noyau est toujours inférieure à la somme des masses de ces constituants, Il y a
une perte de masse m qui se transforme en énergie avec
E = m C2
Un noyau sera d'autant plus stable que son énergie de cohésion sera grande.Cette énergie de
cohésion est de l'ordre du MeV/nucléon : (1 MeV = 106eV = 1,6 10-13 J).
Fig3
La courbe d'Aston (l’énergie moyenne de cohésion par nucléon E/A en fonction de A) :
Les atomes dont l'énergie moyenne de liaison par nucléon est faible ( de E / A < 7,5 MeV /
nucléon) vont chercher a se stabiliser et a se rapprocher de la zone de stabilité maximale vers
A = 60.
Deux processus différents sont possibles :FUSION ou FISSION
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%