Cinétique chimique: Température et catalyseur

Cinétique chimique: Influence de la température et d’un catalyseur
AdM 1
Cinétique chimique: Température et catalyseur
Principe:
La vitesse d’une réaction augmente en général avec la température et l’ajoute d’un
catalyseur (positif) tous les autres paramètres étant maintenus constants.
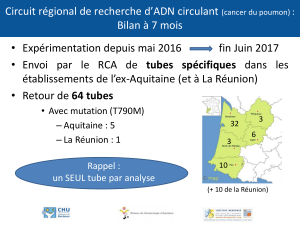
Nous étudions ces deux influences sur l’exemple de la réaction du permanganate de
potassium sur l’acide oxalique en milieu acide :
2MnO4 - +5C2H2O4 + 6H+ J 2Mn 2+ +10 CO2 +8H2O
Le temps t jusqu’à décoloration du permanganate sera mesuré pour estimer la vitesse. En
effet, nous savons que v P 1/Dt (Définition de la vitesse)
Mode opératoire:
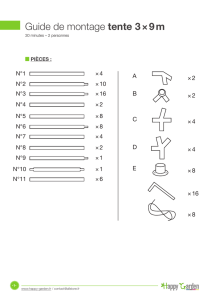
A préparer :
a) une solution de 50 ml de KmnO4 0,5 mM (millimolaire !)
n(KMnO4) ………………………………..….mol
m(KMnO4) ………………………………….g
Cette masse sera pesée avec précision dans un pèse-substances
et transférée sans pertes (voir dessin) dans un jaugé de 50 ml.
Remplir d’eau distillée jusqu’à moitié, agiter pour hâter la
dissolution, puis remplir jusqu’au trait de jauge. Boucher et
agiter pour homogénéiser.
b) une solution de 100 ml d’acide oxalique 0,0075 M
n(C2H2O4) ………………………………..….mol
m(C2H2O4) ………………………………….g
La préparation se fera comme en haut avec un jaugé de 100 ml
c) une solution d’acide sulfurique 0,5 M
d) une solution saturée de MnCl2
A)Dans 4 tubes à essai, verser 5 ml de a) et 1ml de b). Thermostatiser 2 tubes à 20oC, les
autres à 40oC et 60oC.
B)Dans 4 autres tubes, verser 10 ml de b) Thermostatiser 2 tubes à 20oC, les autres à
40oC et 60oC.
Effectuer le mélanges des tubes A avec les tubes respectifs B. Dans l’un des mélanges à
20oC , verser 1 goutte de d) au départ Chrono à chaque mélange!
Mesurer Dt jusqu’à décoloration du permanganate : Chrono !
20oC 20oC 40oC 60oC
Dt (s)
1/Dt (1/s)
1
/
1
100%