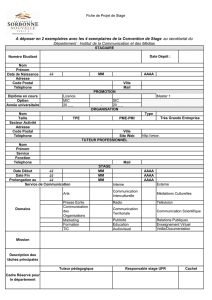
FORMULAIRE DE DECLARATION A : NOTIFICATION D`EFFETS

FORMULAIRE DE DECLARATION A : NOTIFICATION D’EFFETS INDESIRABLES GRAVES
PAR LA PERSONNE RESPONSABLE OU LE DISTRIBUTEUR AUX AUTORITES
COMPETENTES
(selon l’article 23 du Règlement cosmétique n°1223/2009)
1) Rapport de cas
2) Société
Numéro de la société en charge du rapport :
Type de rapport :
Initial De suivi Final
Date de réception de l’information par la société : jj/mm/aaaa
Date d’envoi à l’autorité compétente (ANSM) : jj/mm/aaaa
Distributeur Personne responsable
Nom de la société :
Adresse et coordonnées de la personne à contacter :
3) Critères de gravité
Incapacité fonctionnelle temporaire ou permanente
Handicap
Hospitalisation
Anomalies congénitales
Risque vital immédiat
Décès
4) Informateur principal
5) Utilisateur final
Consommateur
Professionnel de la santé
Autre (spécifier)
Les informations rapportées ont-elles été confirmées par un
membre du corps médical ? Oui Non
Code :
Age (au moment des faits) : Date de naissance : jj/mm/aaaa
Sexe : Féminin Masculin Inconnu
Pays de résidence :
6) Produit suspect
7) Description des Effets Indésirables Graves (EIG)
a) Nom complet du produit suspect :
Société/marque :
Catégorie de produits :
Numéro de lot :
Numéro de notification :
b) Utilisation du produit
Date de première utilisation du produit : jj/mm/aaaa
Fréquence d’utilisation : … fois par (jour/semaine/mois/année)
Usage professionnel : Oui Non
Zone(s) d’application :
L’utilisation du produit a-t-elle été arrêtée ?:
Oui Non Pas concerné Ne sait pas
Date d’arrêt d’utilisation du produit : jj/mm/aaaa
c) Ré-exposition au produit suspect
Récidive Pas de récidive Non réalisée
Ne sait pas
d) Autres produits cosmétiques utilisés concomitamment (Des
informations complémentaires peuvent être jointes au présent
document) :
a) Type d’effet
- Pays de survenue des EIG :
- Date de survenue des EIG : jj/mm/aaaa
- Délai entre la première utilisation du produit et l’apparition
des premiers symptômes (en minutes/heures/jours/mois) :
- Délai entre la dernière utilisation du produit et l’apparition
des premiers symptômes (en minutes/heures/jours/mois) :
- Signes et symptômes rapportés :
- Le cas échéant, diagnostic rapporté :
b) Localisation des effets indésirables graves
Peau
zones corporelles concernées :
Cuir chevelu Cheveux Yeux Dents Ongles
Lèvres
Muqueuses (préciser) :
Autres (préciser) :
EIG sur la zone d’application du produit
EIG à distance de la zone d’application du produit
8) Evolution des effets indésirables graves
Résolue (indiquer le temps nécessaire à la résolution) :
En voie d’amélioration Séquelles Toujours en cours Ne sait pas
Autre
Version : 22 février 2011
: Traduction proposée à titre d’information – elle ne se substitue pas au formulaire officiel en
langue anglaise qui sera envoyé aux autorités compétentes.

9) Autres troubles médicaux antérieurs ou concomitants significatifs
Oui Non si oui, préciser :
Traitements significatifs :
Produits associés éventuels (médicaments, compléments alimentaires, …) :
10) Antécédents médicaux
Allergies (préciser) :
Si des tests ont été réalisés précédemment, préciser le type et les résultats :
Pathologies cutanées (préciser) :
Autres pathologies antérieures significatives :
Caractères cutanés spécifiques dont le phototype :
Autres (par exemple : exposition à des conditions climatiques particulières ou exposition particulière) :
11) Gestion du cas
a) Traitement des effets indésirables graves
Médicaments prescrits : (Nom du produit)
Dose
Durée
b) Autres mesures :
Durée / informations complémentaires :
c) Gravité de l’effet indésirable
c-1) Incapacité fonctionnelle (le cas échéant)
Description :
Si temporaire, préciser la durée :
Résultat d’expertise disponible Certificat médical disponible
Traitement curatif de l’incapacité temporaire :
c-2) Handicap (le cas échéant), préciser le % :
Description :
Résultat d’expertise disponible Certificat médical disponible
c-3) Hospitalisation (le cas échéant) :
Durée de l’hospitalisation : Adresse de l’hôpital :
Traitement curatif reçu durant l’hospitalisation :
Médicaments prescrits : (Nom du produit)
Dose
Durée
c-4) Anomalies congénitales (le cas échéant) :
Détectées durant la grossesse Résultat d’expertise disponible
Détectées après l’accouchement
c-5) Risque vital immédiat (le cas échéant) :
Traitement et mesures spécifiques :
c-6) Décès (le cas échéant) :
Date : jj/mm/aaaa Diagnostic : Certificat médical disponible
Version : 22 février 2011
: Traduction proposée à titre d’information – elle ne se substitue pas au formulaire officiel en
langue anglaise qui sera envoyé aux autorités compétentes.

12) Recherches complémentaires
Oui Non Si oui, préciser :
Enquête allergologique :
Test(s) sur les produits cosmétiques suspects :
Produit(s) testé(s)
Méthode(s) utilisée(s)
Délais de lecture
Résultats
Test(s) sur les ingrédients (s’ils sont disponibles, joindre les résultats complets au formulaire de déclaration)
Autres résultats de tests allergologiques :
Autre(s) recherche (s) complémentaire(s) (préciser y compris les résultats) :
13) Résumé par la Personne responsable ou le Distributeur
a) Récit
b) Suivi
Préciser le numéro d’identification du dossier de l’Autorité compétente (si disponible) :
c) Evaluation du lien de causalité (entre l’EIG et le produit cosmétique concerné)
Très probable Probable Pas clairement imputable Improbable Exclu Impossible à déterminer
d) Gestion du cas
Ces effets indésirables graves ont-ils été déjà soumis à l’autorité compétente ? : Oui Non Ne sait pas
Si oui, à quelle autorité compétente ont-ils été rapportés ? :
e) Actions correctives
Oui Non Si oui, préciser :
f) Commentaires (merci de préciser, le cas échéant, le nombre de pièces jointes en annexe) :
Version : 22 février 2011
: Traduction proposée à titre d’information – elle ne se substitue pas au formulaire officiel en
langue anglaise qui sera envoyé aux autorités compétentes.
: Pour des raisons de confidentialité et des raisons liées à la loi Informatique et Libertés, le
nom et les coordonnées de la personne victime d’EIG ne figurent pas sur le formulaire de
déclaration. Il est recommandé de ne pas les enregistrer sur un ordinateur.
1
/
3
100%