L`hypophyse, pour la compréhension du développement et de la

L’hypophyse, pour la compréhension du développement et de la maladie
Organisation tri-dimensionnelle de l`hypophyse
Mécanismes de spécification de l`identité cellulaire
Régulation hormonale de l’expression des gènes
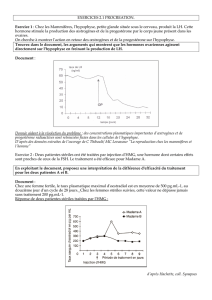
La maladie de Cushing et les adénomes hypophysaires
Spécification de l`identité des membres
L’hypophyse, pour la compréhension du développement et de la maladie
Nous voulons comprendre les mécanismes génétiques et épigénétiques qui contrôlent
l’expression des gènes, la spécification du destin cellulaire (identité de la cellule) et le
développement d`organes complexes.
Nous utilisons principalement l’hypophyse comme modèle d`étude car il s’agit d’un organe
simple composé de six types de cellules différentes, chacune dédiée à la sécrétion d`une
hormone (Drouin J 2010 Pituitary Development. In: Melmed S (ed) The Pituitary 3rd Ed.
Elsevier-Academic Press,3-19/ 4th Ed. 2016, in press). Notre travail porte tout particulièrement
sur le gène de la pro-opiomelanocortine (POMC) qui encode l’hormone ACTH, la mélanotropine
et l’endorphine. La perturbation des cellules de l’hypophyse entraîne soit des carences114, 143, 125
ou une surproduction d’hormones124. Nos découvertes sur les mécanismes du fonctionnement
hypophysaire ont permis l’identification de nouveaux syndromes 103, 124, fourni des outils de
diagnostic et ont ouvert la voie à des approches thérapeutiques nouvelles.
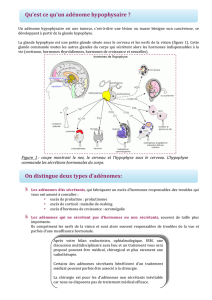
Organisation tri-dimensionnelle de l`hypophyse
Figure 1. Développement de l’hypophyse chez la souris

L'avènement de puissantes technologies d'imagerie des tissus nous a amené à collaborer avec
des collègues de Montpellier FR pour étudier la mise en place de l'organisation
tridimensionnelle des cellules de l`hypophyse. Ce travail a révélé une organisation inattendue
des cellules en réseaux cellulaires homotypiques dans lesquels toutes les cellules de la même
lignée sont en contact avec des cellules similaires144, de telle sorte que ces cellules échangent
des signaux pour la production d`une réponse coordonnée. En outre, ces réseaux
homotypiques interagissent les uns avec les autres depuis leur mise en place au cours du
développement fétal141.
Mécanismes de spécification de l`identité cellulaire
Nos recherches sur les mécanismes de régulation transcriptionnelle de l’expression des gènes
d`hormones hypophysaires ont mené à la découverte de certain facteurs de transcription
essentiels tels que la sous-famille Pitx d`homéoprotéines72, 79, 85, 92, 99, le facteur de transcription
Tpit96, 103, 104 et, plus récemment, le rôle de Pax7 en tant que gène sélecteur d’identité de
l’hypophyse intermédiaire. Nous utilisons la gamme complète des technologies génomiques
pour identifier d’autres régulateurs de la spécification cellulaire139 de l’hypophyse et en
particulier, nous étudions le mécanisme utilisé par Pax7 pour remodeler la chromatine et
refaçonner l’épigénome et ainsi engendrer un destin cellulaire alternatif146. Peu de facteurs ont
une activité pionnière et notre système est unique pour l’étude du mécanisme de
reprogrammation de la chromatine152, 156, 158.
Figure 2. Développement des réseaux cellulaires de l’hypophyse

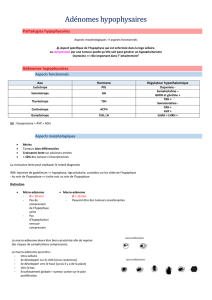
Régulation hormonale de l’expression des gènes
L’expression du gène POMC est contrôlée par des médiateurs centraux (du cerveau) ou par
des hormones du sang comme les glucocorticoides124. Nous avons défini des mécanismes
d’activation du gène POMC par la Corticolibérine (CRH)74, 75, 90, 102, 135 secrétée par
l’hypothalamus, ainsi que pour la rétroaction négative des glucocorticoides et leur récepteur
GR75, 115. Ces deux actions sont médiées par des facteurs de transcription de la famille des
récepteurs nucléaires, soit GR ou des récepteurs orphelins de la sous-famille Nur. Nos
recherches ont conduit à la découverte de nouveaux éléments génomiques de réponse74, 75, des
mécanismes impliquant des intéractions protéines-protéines qui produisent un antagonisme
mutuel (trans-répression)61, 75, 145 ainsi qu’à l’identification de protéines critiques pour la
répression due aux glucocorticoïdes. De plus, nous avons identifié des dérèglements de ces
mécanismes dans les adénomes hypophysaires qui causent la maladie de Cushing122, 137, 157.
Figure 3. Différentiation des cellules hypophysaires
Figure 4. Ouverture de la chromatine par le facteur pionnier Pax7

La maladie de Cushing et les adénomes hypophysaires
En plus des recherches sur la résistance aux glucocorticoïdes dans les adénomes
hypophysaires qui causent la maladie de Cushing122, 137, 157, nous avons étudié le contrôle de la
prolifération cellulaire dans le développement normal de l’hypophyse et dans ces adénomes.
Cette recherche nous a menés à l’identification de mécanismes uniques pour le contrôle du
cycle cellulaire des progéniteurs hypophysaires (cellules souches) par comparaison avec les
cellules différenciées134 et leur remplacement dans la glande adulte149.
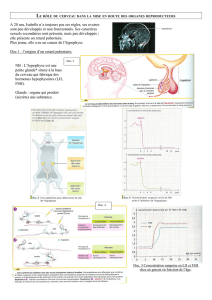
Spécification de l`identité des membres
Notre découverte du premier membre de la famille des facteurs à homeodomaine Pitx (Pitx1)72
a conduit à l’étude du rôle de Pitx1, Pitx2 et Pitx3 au cours du développement. Chacun de ces
facteurs possède des rôles variés et déterminants dans le développement et la maladie. Pitx1
est le gène maître d’une cascade de gènes spécifiant l`identité postérieur des membres, c’est-
à-dire qu’il est le régulateur principal qui fait la différence entre le développement de membres
postérieurs (jambes, pattes) plutôt que de membres antérieurs (bras, ailes)73, 87, 101. Nous
utilisons des approches génomiques pour définir les actions de Pitx1 ainsi que le facteur aval
Tbx4 dans le développement des membres postérieurs136.
Figure 5. Les séquences régulatrices du gène POMC

Les facteurs de transcription Pitx dans le développement
Nous avons également étudié le rôle de Pitx3 dans les neurones dopaminergiques du
mésencéphale. L’expression de Pitx3 dans le cerveau est limitée aux neurones les plus
sensibles à dégénérescence dans la maladie de Parkinson et Pitx3 joue un rôle de survie dans
ces neurones. Ainsi, Pitx3 et le réseau de gènes qu’il contrôle pourraient expliquer la sensibilité
particulière de ces neurones à la dégénérescence. Récemment, nous avons identifié un de ces
gènes dépendant de Pitx3 et montré qu`il est également crucial pour la survie des neurones : la
mutation de ce gène cause une dégénérescence tardive semblable à celle observée chez
l`homme dans la maladie de Parkinson153. Pitx2 et Pitx3 sont deux régulateurs essentiels du
développement du muscle squelettique, en particulier lors de la transition entre les précurseurs
musculaires et les cellules différenciées du muscle. Les deux facteurs Pitx ont des rôles
séquentiels et en partie partagés mais la perte de leur fonction mène à l’atrophie des
muscles151.
Les numéros de citation réfèrent à la Liste complète des publications
Figures 6 et 7. Spécification de l’identité des membres postérieurs par Pitx1 et Tbx4
1
/
5
100%