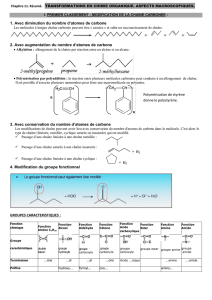
cours molecules

Carbone Soufre Fer

Chapitre
Les molécules
Eau
Méthane

Activité 1 : Formulation
d'une hypothèse
Elément
Numéro atomique
Structure électronique
H
O
N

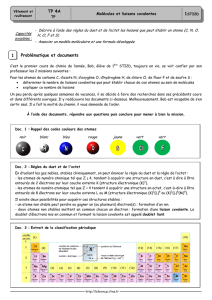
Activité 2 : Modèle de la liaison
chimique et règle de l'octet
MODÈLE DE LA LIAISON CHIMIQUE COVALENTE
Ne sont pas concernés par ce modèle :
Les solides ioniques, par exemple NaCl ou MgO. Ces solides ioniques ne sont pas constitués de
molécules mais d’ions.
Les solides métalliques, par exemple, le fer, le cuivre…
Énoncé n°1 - Dans une molécule, les atomes sont liés par des liaisons chimiques (dites
covalentes).
Énoncé n°2 - Une liaison chimique correspond à la mise en commun de deux électrons : un
électron par chacun des atomes. Ces deux électrons mis en commun sont localisés entre les
deux atomes et on considère qu'ils entourent tous les deux chacun des atomes : chaque liaison
chimique formée apporte ainsi un électron supplémentaire dans l'entourage de l'atome ;
Énoncé n°3 - On représente ces 2 électrons par un trait entre les symboles des 2 atomes :
exemple H—Cl.
Énoncé n°4 - Deux atomes peuvent aussi être liés par une double liaison covalente ou une
triple liaison covalente.

 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
1
/
20
100%