chapitre 4 Interprétation atomique des transformation chimique

Classe de quatrième Organisation et transformation de la matière
Décrire la constitution et les états de la matière
Chap. 4
1
Interprétation atomique des transformations chimiques
Objectifs : - distinguer les atomes des molécules
- écrire son équation de réaction
- Savoir que la masse se conserve lors d’une transformation chimique
- savoir associer les symbole aux éléments à l'aide de la classification périodique
- Savoir ce qu'est la classification périodique
- interpréter une formule chimique en termes atomiques
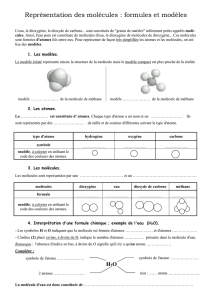
I. Les atomes constituants des molécules
1) Les atomes des molécules
Pour comprendre une transformation chimique, il faut connaître la structure moléculaires des
réactifs.
Les molécules sont constituées ............................................., liés les uns aux autres. Ils sont très
petits, puisque la taille des molécules se mesurent en nanomètre.
Pour se faire une image/une idée, de ces molécules et de ses atomes, on peut modéliser les atomes
par des sphères :
2) Symbolisation et modélisation des atomes
Pour différentier les atomes, on utilise un code couleurs :
Atome oxygène hydrogène
carbone Azote
Symbole
Modèle
atomique
3) Classification périodique des éléments
Il existe beaucoup d’autres atomes.
Les scientifiques les ont tous ranger dans un document en fonction de leurs..................................
.......................................: le ................................................................................................... ou
classification périodique.

Classe de quatrième Organisation et transformation de la matière
Décrire la constitution et les états de la matière
Chap. 4
2
II. La formule des molécules
1) Définition
On peut représenter une molécule par son modèle (un ensemble de ...........................................
..........................), mais aussi par sa ............................................... Sa formule doit dire quels
................................... constituent la molécule, ainsi que .......................................... de chacun de
ces atomes.
Exemple :
la molécule d’eau Est formée de : Se symbolise par :
1 atome d’oxygène :
O
2 atomes d’hydrogène :
H
2
D’où l’écriture :
H
2
O

Classe de quatrième Organisation et transformation de la matière
Décrire la constitution et les états de la matière
Chap. 4
3
La molécule de Est formée de : Se symbolise par :
dioxyde de carbone
2) Application
TP : Formule et molécules
1. A partir de leurs modèles dessinés ci-dessous, donner la formule des molécules suivantes :
2. Parmi les molécules précédente, retrouve la molécule d'eau, la molécule de dioxygène, la
molécule de dioxyde de carbone
3. A l'aide de la boîte de modèle moléculaire, construit les molécules suivantes. fait valider tes
modèles dès que tu dois les démonter pour en fabriquer d'autres.
H
2
O ; O
2
; C
2
H
6
; C
4
H
10
; CO
2
; CH
4
; CO
III. Transformation chimique
1. Rappels
Définition : Lors d’une transformation chimique, des substances réagissent ensemble pour former
de nouveaux corps. Les liaisons dans les molécules des réactifs se cassent, pour former de
nouvelles molécules : les produits.
Exemple :
Un glaçon fond dans un verre : transformation …………………..
Une cigarette se consume : transformation …………………….
Un sucre se dissout dans le café : transformation …………………….
Une bûche brûle dans la cheminée : transformation …………………
1 atome de ............... : ....
2 atomes d’..................... :..
D’où l’écriture : ………..

Classe de quatrième Organisation et transformation de la matière
Décrire la constitution et les états de la matière
Chap. 4
4
2. Modélisation d’une transformation chimique : l'équation de réaction
chimique
Pour représenter une transformation chimique, il est commode de donner l'équation de réaction
chimique.
Ces équations chimiques permettent de savoir d'un coup d'œil, quels sont les réactifs et les produits
de la transformation chimique. Elles s'articulent suivant le modèle :
............................. + ........................... .......................... + .......................
3. Application : retour sur la combustion du fusain
Lors du TP sur la combustion du fusain dans le dioxygène, nous avions établi l’équation chimique
de cette réaction : ............................... + ................................... → ..............................................
En utilisant les formules chimiques des réactifs :
• fusain : C
• dioxygène : O
2
• dioxyde de carbone : CO
2
On obtient l'écriture suivante : .................. + .................. .......................
On remarque que tous les atomes présents avant la transformation sont toujours présents après la
transformation : aucun ne s’est crée, aucun n’a disparu.
IV. Loi de conservation de la masse
1. Approche microscopique
Dans le flacon, lors de la combustion du fusain, on a :
Avant la réaction :
• nombre d’atome d’oxygène : ………
• nombre d’atome de carbone : ………
Après la réaction :
• nombre d’atome d’oxygène : ………
• nombre d’atome de carbone : ………
Conclusion : au cours d’une transformation chimique, les liaisons des molécules se cassent, les
atomes des réactifs s’associent différemment pour former de nouvelles molécules : les produits de la
transformation.
« rien ne perd, rien ne se crée, tout se transforme » Lavoisier.

Classe de quatrième Organisation et transformation de la matière
Décrire la constitution et les états de la matière
Chap. 4
5
2. Approche macroscopique
TP Etude de la réaction entre l'acide acétique (le vinaigre) et le carbonate de calcium (la
craie)
réactifs : Nous mettons en présence de l’acide éthanoïque (présent dans le vinaigre) et du carbonate
de calcium (présent dans la craie).
Observation : Nous avons observé une effervescence caractéristique d’un dégagement gazeux : il se
forme un gaz (du dioxyde de carbone).
Equation de réaction chimique : On peut symboliser cette transformation par l’équation de
transformation chimique :
........................ + ........................... → .................................................
Etude de la masse :
Masse avant la transformation chimique : M =……. g
Masse après la transformation chimique : M = ……. g
Conclusion : Au cours d’une transformation chimique, la masse totale ..........................................
........................, en effet les atomes présents dans les produits sont ceux qui composaient les
réactifs.
La masse totale se conserve puisqu’il y a les mêmes atomes avant qu’après.
1
/
5
100%