Partie 1: LES GAZ

Partie 1
:
LES GAZ
Résumé
1) Qu’est-ce que le mouvement brownien? c’est le mouvement désordonné et
incessant des molécules.
2) Quels sortes de mouvement la matière peut-elle avoir?
1˚) Vibration (oscillation): mouvement où les atomes constituant la molécule
s’attirent ou se repoussent (les atomes vibrent).
2˚) Rotation: mouvement où la molécule tourne sur elle-même dans l’espace
disponible.
3˚) Translation: mouvement rectiligne des molécules dans l’espace.
3) Quels sont les propriétés des différents états de la matière?
PROPRIÉTÉS
SOLIDE
LIQUIDE
GAZEUX
Forme
Définie
Indéterminée
Indéterminée
Volume
Définie
Définie
Indéterminée
Compressibilité
Non compressible
Non compressible
Compressible
Diffusion
Nulle
Faible
Grande
Ordre
Ordre élevé
Ordre moyen
Désordre
Mouvement
Vibration
Vibration
Rotation
Translation faible
Vibration
Rotation
Translation
Masse volumique
Très grande
Moyenne
Très faible
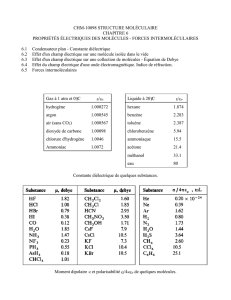
4) a) Qu’est-ce que les forces de Van Der Waals? ce sont les forces d’attraction
entre les molécules.
b) Comment évoluent-elles selon l’état de la matière? Elles sont
1˚) très grandes pour les solides (les molécules sont près les unes des autres),
2˚) faibles pour les liquides (molécules éloignées les unes des autres) et
3˚) presqu’inexistantes pour les gaz (molécules très éloignées)
5) Qu’est-ce qu’un gaz parfait (ou idéal)? C’est un gaz où il n’y a aucune force
d’attraction entre les molécules c’est-à-dire que les forces de Van der Waals sont
considérées comme étant inexistantes.

6) a) Comment appelle-t-on la théorie qui nous permet de comprendre le
comportement des gaz? THÉORIE CINÉTIQUE MOLÉCULAIRE
b) En quoi consiste-t-elle? 1˚) Les gaz sont constitués de particules très
petites appelées molécules.
2˚) Les distances entre les molécules d’un gaz sont très grandes à comparer
aux dimensions des molécules elles-mêmes.
3˚) Ces molécules bougent tout le temps en lignes droites dans toutes les
directions.
4˚) L’énergie cinétique des particules est directement proportionnelle à la
température. À une température donnée, l’énergie cinétique moyenne des
molécules de tous les gaz est la même.
5˚) Les molécules d’un gaz s’entrechoquent continuellement et heurtent les
parois du récipient qui les renferme.
6˚) Toutes ces collisions s’effectuent sans perte d’énergie.
7) a) Qu’est-ce que la loi de Graham? c’est la loi expliquant la vitesse de diffusion
des gaz. Pour une température et une pression données, l’énergie cinétique des
molécules gazeuses étant la même, plus la masse moléculaire d’une molécule
gazeuse sera grande plus sa vitesse de diffusion sera petite.
b) Quelle en est son expression mathématique?
v1 = √ (m2) ou v12 = m2
v2 √ (m1) v22 m1
8) Quels sont les 4 facteurs qui influencent le comportement des gaz?
(nom, variable et unité.)
1˚) Le volume (V) (espace occupé) en litres (L) ou millilitres (mL).
2˚) Le nombre de molécules (n) en moles (mol.
3˚) La pression (p) en kilopascal (kPa) ou millimètres de mercure (mm de Hg)
4˚) La température (T) en degré kelvin (K) (K = ˚C + 273).
9) Quelle relation mathématique permet de relier ces 4 facteurs?
p1 x V1 = p2 x V2
n
1 x T1 n
2 x T2

10) Quelle est la loi de Gay-Lussac? Lors d’une réaction chimique dans les
mêmes conditions de température et de pression, il existe un rapport simple
entre les volumes des gaz réagissant et les volumes des gaz produits.
11) a) Quelle est la loi de Dalton? “La pression totale d’un mélange gazeux est
égale à la somme des pressions partielles de chacun des gaz constituant le
mélange.”
b) Quelle est son expression mathématique? pt = p1 + p2 + p3 + . . .
12) Quelle est la loi des gaz parfaits? p x V = n x R x T
b) Qu’est-ce que “R”? c’est la constante des gaz parfaits.
Sa valeur est: R = 8,31 L . kPa/K . mol
R = 62,36 L . mm de Hg/K . mol.
13) a) À quel nombre correspond 1 mole (mol)? 6,023 x 1023
b) Comment calcule-t-on le nombre de moles (n) à partir de la masse d’une
substance chimique? n = m
M
où m = masse de la substance chimique en grammes (g)
où M = masse molaire de la substance chimique en grammes (g/mol)
14) a) Qu’est-ce que la masse molaire? C’est la masse que possède 1 mole de
molécules (M). On l’obtient en prenant la masse atomique et en y ajoutant l’unité
“gramme/mole (g/mol)”.
b) Quelle est son expression mathématique? M = m x R x T
p x V
15) a) Qu’est-ce que le volume molaire? C’est le volume occupé par 1 mole de
molécules (V/n).
b) Quelle est son expression mathématique? V = R x T
n p
1
/
3
100%