essais immunologiques-1

177
5. Essais immunologiques
Les essais immunologiques sont basés sur la réaction spécifique
entre un antigène et un anticorps, les biomolécules impliquées
dans le système immunitaire, pour la détection et quantification
d’antigènes.
Les essais immunologiques constituent une des méthodes les
plus communes en chimie bioanalytique pour le diagnostic et
contrôle des maladies.
Des anticorps (Ab) ou des immunoglobulines (Ig) sont des
glycoprotéines (masse moléculaire de 150 kDa) dont la synthèse
est déclenchée dans l'organisme par injection d'un antigène
(produit d’une réponse immunitaire). Les anticorps sont bivalent;
ils contiennent deux sites de liaison identiques par molécule.
Des immunogènes ou des antigènes (Ag) sont des substances
(masse moléculaire > 1 kDa) dont l'injection provoque la synthèse,
par l'organisme, d'anticorps spécifiques.
178
Les anticorps et antigènes contiennent des sites de reconnaissance
moléculaire, appelés « paratope » et « épitope », respectivement.
Un anticorps réagit spécifiquement avec un antigène complémentaire
pour former un complexe Ab-Ag:
La spécificité des interactions Ab-Ag est analogue à celles entre substrat et
enzyme. Cette grande spécificité permet dans plusieurs cas l’analyse directe
de matrices complexes, tel que du sang ou de l’urine non-traité.
L’affinité d’un anticorps pour son antigène est très élevée et il y a liaison
même à des concentrations très faibles. Ceci explique la sensibilité élevée
des essais immunologiques.
Des limites de détection de l’ordre du fmol (10-15 mol) peuvent être atteintes
pour certains essais.
(D’après Manz, Pamme & Iossifidis,
Bioanalytical Chemistry, 2004)

179
5.1 Structure et propriétés des anticorps
Toutes les immunoglobulines
sont constituées de:
- 2 chaînes polypeptidiques
« légères » de 25 kDa chacune
- 2 chaînes polypeptidiques
« lourdes » de 50 kDa chacune.
Ces 4 chaînes sont associées
ensemble par des liens
disulfures et des interactions
non-covalentes.
Chaque molécule est un dimère
symétrique en forme de « Y ».
Les deux moitiés d’une
immunoglobuline naturelle sont
identiques.
axe de symétrie
180
(D’après Manz, Pamme & Iossifidis,
Bioanalytical Chemistry, 2004)
bouts N-terminal
fragments Fab
(sites de liaison
de l’antigène)
bouts C-terminal
fragments Fc
(classe d’anticorps)
(L)
(H)
bout C-terminal

181
Propriétés des différentes classes
d’immunoglobulines
(D’après Manz, Pamme & Iossifidis, Bioanalytical Chemistry, 2004)
182
Dans une molécule d’Ig, on retrouve des régions constantes
(C) et des régions variables (V) qui sont constituées de
motifs spécifiques de repliement des séquences d’acides
aminés.
Les régions constantes sont les
mêmes pour chaque Igd’une classe
et sont localisées au bouts C-terminal
des chaînes légères (CL) et sur les
bouts C-terminal des chaînes lourdes
(CH1, CH2, CH3).
Les régions variables constituent
les paratopes ou sites anticorps
qui visent l’antigène d’intérêt.
Il y a 2 sites anticorps identiques
par molécule.
Les paratopes sont situés aux extrémités
de la forme « Y », dans les régions N-terminal
des châines légères (VL) et lourdes (VH).
Les paratopes possèdent une structure permettant
une interaction complémentaire avec les éléments
structuraux et groupements fonctionnels sur la surface
de l’antigène.
(D’après Manz, Pamme & Iossifidis,
Bioanalytical Chemistry, 2004)

183
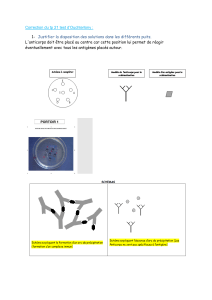
Anticorps polyclonaux vs. monoclonal
On peut identifier 2 types d’anticorps: des anticorps polyclonaux et un
anticorps monoclonal.
Anticorps polyclonaux:
- un mélange complexe d'immunoglobulines isolées du sérum sanguin
- Ces anticorps reconnaissent une série d'épitopes différents.
- Ils possèdent une large gamme de sélectivités et affinités. Ceci peut
donner lieu à des réactivités croisées ou à des interférences dans un essai
immunologique.
Anticorps monoclonal:
- anticorps spécifique sécrété par les hybridomes produits grâce aux
méthodes de la technologie des hybridomes (impliquant des cultures
cellulaires)
- Il se lie à un épitope particulier .
- Les anticorps monoclonaux sont plus spécifiques et possèdent des
propriétés plus reproductibles. Ils sont les anticorps de choix pour les
essais analytiques.
184
Les immunoglobulines peuvent être
coupées en fragments par traitement
enzymatique.
La papaïne coupe l’immunoglobuline
en 3 fragments d’environ 50 kDa chacun:
2 Fab et 1 Fc.
Puisque les fragments Fab contiennent les
paratopes, ils retiennent leur capacité à lier
l’antigène.
Le fragment Fcest facilement cristallisable. Il
ne contient pas de sites de reconnaissance
de l’antigène.
La pepsine coupe l’immunoglobuline à la
base, en dessous du pivot, produisant un
fragment F(ab)2. Le fragment F(ab)2 contient
les 2 paratopes.
Les fragments Fab et F(ab)2 sont à l’occasion
utilisés dans des essais immunologiques
au lieu de l’immunoglobuline entière.
(D’après Manz, Pamme & Iossifidis, Bioanalytical Chemistry, 2004)
papaïne
pepsine

185
5.2 Structure et propriétés des antigènes
L’épitope ou déterminant antigénique
est la partie de l’antigène qui interagit
de manière spécifique avec le site
anticorps.
Les dimensions d’un épitope: ~ 0.7 x
1.2 x 3.5 nm (l’équivalent d’environ 5
à 7 acides aminés).
Il y a deux types antigènes: les
antigènes complets et les antigènes
incomplets. (D’après McMurry & Castellion,
Fundamentals of General, Organic
& Biological Chemistry, 4è éd., 2003)
186
Antigènes complets:
- peuvent induire une réaction immunitaire par eux-mêmes (ex. un
microorganisme)
Antigènes incomplets ou haptènes:
- molécules de plus faible masse moléculaire qui ne peuvent pas
induire de réaction immunitaire par elles-mêmes
- Lorsqu’attaché à une protéine (transporteur protéique), telle que
l’albumine ou la ferritine, un haptène peut stimuler la production
d’anticorps spécifiques. Une fois produits, les anticorps anti-haptène
reconnaîtront l’haptène même sans le transporteur protéique.
- Les haptènes présentent généralement un seul épitope.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%