TSS-01 Ex.04 : Cycle de l`eau et dioxyde de carbone

TS spé www.pichegru.net 2016
- 1 -
Ex 1.4 - Le cycle de l’eau et le CO2 atmosphérique
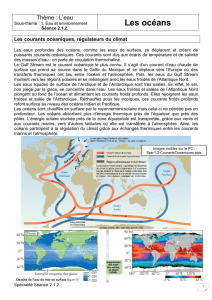
L’eau joue un rôle important dans le climat de la Terre, et pas seulement
sous forme d’océans. Le cycle de l’eau (évaporation des océans,
précipitation, ruissellement et retour aux océans) joue un rôle majeur
dans la régulation de la teneur en CO
2
de l’atmosphère et donc dans le
climat global, à l’échelle de temps géologique.
Document 1 : Érosion de certaines roches
Au contact de l’eau et en présence de CO
2
, certaines roches subissent
une réaction chimique qui va contribuer à leur érosion. En voici
quelques exemples :
Anorthite : CaAl
2
Si
2
O
8
+ 2 CO
2
+ 3 H
2
O
Al
2
Si
2
O
5
(OH)
4
+ Ca
2+
+ 2 HCO
3–
Silicates magnésiens : MgSiO
3
+ CO
2
MgCO
3
+ SiO
3
Silicates calciques : CaSiO
3
+ CO
2
CaCO
3
+ SiO
3
Magnésite : MgCO
3
+ CO
2
+ H
2
O 2 HCO
3–
+ Mg
2+
Calcite : CaCO
3
+ CO
2
+ H
2
O 2 HCO
3–
+ Ca
2+
Remarque : Les silicates constituent 97 % de la croûte terrestre !
Les ions Ca
2+
, Mg
2+
et HCO
3–
se dissolvent dans les eaux de
ruissellement et finissent dans les océans. Lorsque leur limite de
solubilité est atteinte, ils précipitent en concrétion calcaire ou
magnésienne selon les réactions :
Ca
2+
+ 2 HCO
3–
CaCO
3
+ CO
2
+ H
2
O
Mg
2+
+ 2 HCO
3–
MgCO
3
+ CO
2
+ H
2
O
L’érosion des roches sur les continents et la précipitation des ions
carbonate dans l’océan s’opposent donc en terme de bilan d’espèces
chimiques produites et consommées.
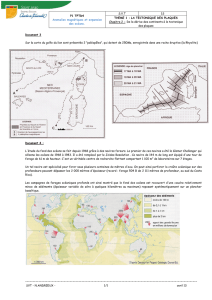
Document 2 : Stockage du carbone d’origine organique et
minéral dans les océans
Questions
1. Faire le bilan en CO
2
de l’érosion des 5 minéraux cités dans le
document. Quels sont ceux dont l’érosion contribue à diminuer la teneur
en CO
2
de l’atmosphère, en tenant compte de la concrétion des
carbonates de calcium et de magnésium dans les océans ? Justifier votre
réponse par une équation-bilan globale.
2. En quoi le cycle de l’eau permet-il un enfouissement du carbone
organique ? Cela a-t-il une influence sur la teneur en CO
2
de
l’atmosphère.
3. Rédigez une courte synthèse expliquant l’influence du cycle de l’eau
sur la teneur en CO
2
de l’atmosphère. Vous expliquerez pourquoi ces
mécanismes sont inefficaces pour contrer l’augmentation du CO
2
anthropique dans l’atmosphère.
Correction
1. Anorthite : son érosion consomme 2 CO
2
, puis en produit 1 lors de la
précipitation des ions HCO
3–
dans l’océan.
CaAl
2
Si
2
O
8
+ 2 CO
2
+ 3 H
2
O Al
2
Si
2
O
5
(OH)
4
+ CaCO
3
+ CO
2
+ H
2
O
Cela contribue donc à diminuer la teneur en CO
2
de l’atmosphère.
Même raisonnement et conclusion pour les silicates.
En revanche, l’érosion de la magnésite et de la calcite est neutre en CO
2
MgCO
3
+ CO
2
+ H
2
O 2 HCO
3–
+ Mg
2+
MgCO
3
+ CO
2
+ H
2
O
2. L’eau amène les particules organiques jusqu’à la mer où elle seront
enfouies. Ce carbone provenant du CO
2
atmosphérique et n’y retournant
pas, cela a bien un impact sur la teneur en CO
2
de l’atmosphère.
3. Synthèse : Arguments à faire figurer.
• Érosion des roches par l’eau, puis concrétion du HCO
3–
résultant de
cette érosion, au fond des océans.
• Transformation du CO
2
en carbone organique par les plantes, puis
lessivage de ce carbone organique jusqu’au océans où il sédimentera
• Ces mécanismes sont beaucoup trop longs (échelle des millions
d’années) pour contrer l’augmentation anthropique très rapide.
1
/
1
100%