Actualités sur la maladie de Kawasaki

Médecine
& enfance
Rubrique dirigée par F. Bajolle
mars 2013
page 72
tal, couplée à une prédisposition géné-
tique [3, 4]. En effet, l’incidence plus éle-
vée relevée au Japon et chez les enfants
d’origine japonaise vivant aux Etats-
Unis ou en Grande-Bretagne, ainsi que
l’observation de cas familiaux suggèrent
cette prédisposition génétique. Les épi-
démies hivernales et printanières et
l’âge de survenue de la maladie sont des
arguments en faveur d’une origine in-
fectieuse. La gravité est due au fait que
les coronaires peuvent, essentiellement
lors de la phase subaiguë, être lésées et
le siège d’anévrismes [5]. Les facteurs
prédictifs de développement d’ané-
vrismes coronaires sont un âge inférieur
à un an et supérieur à huit ans, le sexe
masculin, un retard diagnostique
(fièvre et éruption prolongées), le ca-
ractère réfractaire, l’intensité et la per-
sistance des perturbations biologiques.
Les facteurs prédictifs de régression des
anévrismes sont : anévrismes de petite
taille, fusiformes et distaux, âge infé-
rieur à un an.
TABLEAUX CLINIQUES
Bien qu’il n’existe pas de signe clinique
ou biologique pathognomonique de la
GÉNÉRALITÉS
La maladie de Kawasaki, deuxième vas-
cularite la plus fréquente de l’enfant
après le purpura rhumatoïde, a été dé-
crite par le médecin japonais Tomisaku
Kawasaki il y a cinquante ans. Son dia-
gnostic est clinique et fait poser l’indica-
tion d’un traitement intraveineux par
immunoglobulines humaines (IgIV), as-
socié à de l’aspirine à dose anti-inflam-
matoire [1]. La tranche d’âge la plus tou-
chée se situe entre six mois et cinq ans.
Plus de la moitié des cas surviennent
chez des enfants de moins de deux ans.
Cette maladie touche plus fréquemment
les garçons (1,5/1). Décrite initiale-
ment au Japon, puis à Hawaï, aux Etats-
Unis, au Canada et en Europe, l’inciden-
ce de la maladie augmente globalement
dans le monde entier. Elle est évaluée à
216 cas pour 100000 enfants de moins
de cinq ans par an au Japon [2]. En Fran-
ce, elle est probablement de mieux en
mieux diagnostiquée, et l’estimation de
l’incidence serait d’environ 600 nou-
veaux cas par an, mais il n’existe pas de
registre national à ce jour. La maladie
résulte probablement de l’exposition à
un agent étiologique ou environnemen-
La maladie de Kawasaki est une vascularite qui touche essentiellement l’enfant
de moins de cinq ans et plus fréquemment les garçons que les filles. Il peut
exister des formes chez le jeune nourrisson de moins de un an, auxquelles il
faut penser car elles sont plus à risque d’anévrisme coronaire. Les progrès thé-
rapeutiques ont permis de diminuer l’incidence des atteintes coronaires de
25-30 % à 3-5 %. Le diagnostic reste clinique, et le pédiatre de ville a un rôle
majeur à jouer dans la prise en charge rapide de cette maladie. Il va adresser
le patient aux urgences, car le traitement initial repose sur une perfusion lente
d’immunoglobulines humaines associée à de l’aspirine à dose anti-inflamma-
toire. Certains patients, dits réfractaires, restent fébriles ou le redeviennent
dans les trente-six heures suivant la fin de la perfusion d’immunoglobulines.
Ces patients ont un risque plus élevé d’atteinte coronaire et nécessitent un
renforcement du traitement médical. Le suivi cardiologique à long terme est
organisé en fonction de l’existence ou non d’une atteinte coronaire.
Actualités sur la maladie
de Kawasaki
F. Bajolle, centre de référence
Malformations cardiaques congénitales
complexes, M3C-Necker,
hôpital Necker-Enfants Malades, Paris
CARDIOPÉDIATRIE

Médecine
& enfance
mars 2013
page 73
maladie, le diagnostic reste essentielle-
ment clinique. La fièvre doit être asso-
ciée à quatre des cinq critères majeurs
(voir tableau) pour que le diagnostic soit
posé avec certitude [1]. Dans les formes
atypiques, le tableau clinique est domi-
né par un symptôme inhabituel : diar-
rhée sanglante secondaire à une entéro-
colite, convulsions, ascite, obstruction
des voies aériennes supérieures, œdème
pulmonaire secondaire à une myocardi-
te sévère, épiglottite, adénopathies cer-
vicales compressives, hémolyse, syndro-
me néphrotique, hyponatrémie ou syn-
drome de défaillance multiviscérale.
Ces formes se différencient des formes
incomplètes où la fièvre, présente de-
puis plus de cinq jours, est associée à
seulement deux ou trois critères cli-
niques ou biologiques classiques. Des
signes supplémentaires (voir tableau) doi-
vent alors être recherchés, et le cardio-
logue peut être mis à contribution pour
aider le pédiatre à trancher sur l’oppor-
tunité d’un traitement par des immuno-
globulines, une échographie cardiaque
anormale pouvant signer le diagnostic
et faire débuter le traitement [1].
La présence d’un érythème induré,
d’une croûte ou d’une ulcération au ni-
veau de la cicatrice du BCG est un très
bon signe de la maladie (figure 1). Ce
signe, peu connu en France, est présent
chez 50 à 70 % des patients japonais [6].
Lorsque le médecin traitant constate
une desquamation en doigt de gant des
extrémités (figure 2) chez un enfant non
suivi pour une maladie de Kawasaki
dans les semaines précédentes, il doit
prescrire une échographie cardiaque
pour s’assurer de l’absence de lésions
coronaires.
Enfin, des formes de l’adulte et de l’ado-
lescent ont été rapportées. Les symp-
tômes majeurs sont identiques à ceux des
enfants, mais les troubles digestifs, l’at-
teinte hépatique, les signes articulaires et
les encéphalites sont plus fréquents.
PRISE EN CHARGE
THÉRAPEUTIQUE
Elle doit être précoce et repose sur une
Critères cliniques et paracliniques, classiques et supplémentaires
Critères cliniques classiques :
첸conjonctivite bulbaire non purulente
첸atteinte muqueuse : pharyngite, chéilite, langue framboisée, stomatite
첸exanthème polymorphe du tronc
첸atteinte des extrémités : érythème des paumes des mains et/ou des plantes des pieds, œdème
palmo-plantaire, desquamation palmo-plantaire secondaire
첸atteinte unilatérale des ganglions cervicaux : adénopathies de plus de 1,5 cm de diamètre
Critères biologiques classiques : Critères biologiques supplémentaires :
첸élévation de la VS 첸albumine ≤ 3 g/dl
첸élévation de la CRP 첸anémie pour l’âge
첸hyperleucocytose 첸plaquettes ≥ à 450000 au 7ejour
첸anémie 첸GB ≥ 15000
첸thrombocytose 첸ECBU ≥ 10000 GB
첸hypoalbuminémie Echographie cardiaque anormale
첸hyponatrémie
첸augmentation des transaminases et des gamma-GT
첸pyurie aseptique, protéinurie, hématurie
첸hyperleucocytose du liquide synovial
첸méningite lymphocytaire aseptique
Critères cliniques supplémentaires :
첸cardiovasculaires : dilatation des artères coronaires, anévrismes coronaires, infarctus, myocardite
avec possible insuffisance cardiaque congestive, péricardite, épanchement péricardique, fuites
valvulaires, anévrismes des vaisseaux du cou, des artères rénales, spléniques, hépatiques,
pancréatiques, génitales, gangrènes distales et pseudo-Raynaud
첸digestifs : diarrhées, vomissements, douleurs abdominales, hydrocholécyste, dysfonction
hépatique
첸respiratoires : toux et rhinorrhée
첸neuroméningés : troubles de la conscience avec irritabilité, apathie, état grognon, hypoacousie
첸articulaires : arthrite, arthralgies
첸autres : uvéite, érythème au niveau de la cicatrice de BCG, desquamation de l’aine
Exclusion des diagnostics différentiels :
첸origine virale : adénovirus, entérovirus, 첸adénopathie bactérienne
EBV, rougeole 첸hypersensibilté aux médicaments
첸scarlatine 첸syndrome de Stevens-Johnson
첸syndrome d’épidermolyse staphylococcique 첸polyarthrite juvénile
첸syndrome du choc toxique 첸leptospirose
Figure 1
Inflammation sur la cicatrice de BCG
Figure 2
Desquamation typique en doigt de gant

Médecine
& enfance
mars 2013
page 74
perfusion lente d’immunoglobulines hu-
maines associée à de l’aspirine à dose an-
ti-inflammatoire [1]. La tolérance des im-
munoglobulines est le plus souvent ex-
cellente. Les IgIV sont des médicaments
dérivés du sang et doivent donc être no-
tées dans le dossier transfusionnel de
l’enfant comme dans son carnet de san-
té. Le traitement par l’aspirine à dose an-
ti-inflammatoire ne diminue pas la fré-
quence des lésions coronaires, raison
pour laquelle son utilisation à cette dose
est très discutée actuellement [6]. Cepen-
dant, les dernières recommandations
maintiennent l’indication de la dose anti-
inflammatoire suivie d’une dose antipla-
quettaire [7]. Le traitement de choix et de
première intention reste la perfusion
d’IgIV. Elle doit être faite le plus précoce-
ment possible et idéalement dans les
sept premiers jours de fièvre. Elle reste
efficace après dix jours de fièvre et per-
met la résolution de l’inflammation, mais
elle est trop tardive pour prévenir la sur-
venue de lésions coronaires [8]. La prise
en charge initiale et à moyen terme est
synthétisée dans la figure 3.
Il faut savoir évoquer les formes résis-
tantes ou réfractaires lorsque les pa-
tients restent fébriles ou le redevien-
nent dans les trente-six heures suivant
la fin de la perfusion d’immunoglobu-
lines [1]. Le taux de résistance peut at-
teindre 40 % mais est évalué à 20 %
dans la majorité des pays [6]. Cette ré-
ponse insatisfaisante au traitement ini-
tial est associée à un risque plus élevé
d’atteinte coronaire. Des critères prédic-
tifs de résistance ont été identifiés : en-
fant de moins de six mois, diagnostic
précoce (avant quatre jours de fièvre),
certaines anomalies biologiques ini-
tiales et la présence d’anomalies écho-
graphiques initiales. Ces non-répon-
deurs doivent être traités par une
deuxième dose d’immunoglobulines de
2 g/kg [8]. Récemment, le score d’Ega-
mi, qui aide à prédire le caractère résis-
tant de la maladie, a été utilisé dans une
étude randomisée pour évaluer le béné-
fice d’un bolus de corticoïdes associé à
la deuxième perfusion d’IgIV. Les pa-
tients résistants avec un score élevé qui
avaient reçu un bolus de corticoïdes et
une perfusion d’héparine en même
temps que la deuxième injection d’IgIV
étaient plus améliorés que les patients
résistants n’ayant reçu qu’une deuxième
injection d’IgIV [9]. D’autres traitements
pourraient s’avérer utiles dans ces
formes particulièrement sévères.
Enfin, on conseille d’attendre au mini-
mum six semaines (de préférence trois
mois) après une perfusion d’IgIV pour
administrer des vaccins constitués de vi-
rus vivants atténués (rougeole, rubéole,
oreillons, varicelle, etc.) pour éviter
d’entraver leur efficacité.
Figure 3
Prise en charge de la maladie de Kawasaki
첸Immunoglobulines à 2 g/kg en intraveineux à la seringue électrique sur 12 h
첸Aspirine 80 mg/kg/j (dose anti-inflammatoire) jusqu’à l’apyrexie, puis 1-5 mg/kg/j (dose AAP)
첸Echographie cardiaque et ECG hebdomadaires pendant 4 semaines
Jamais d’atteinte coronaire :
AAP pendant 8 semaines
Consultation à 3 mois
Arrêt de l’AAP et clôture du dossier
Atteinte coronaire :
AAP au moins un an
+ AVK si anévrisme > 6 mm
Coroscanner à un an si dilatation coronaire
et/ou anévrisme < 6 mm
Coronarographie à un an si anévrisme > 6 mm
Coronaires normales
Arrêt de l’AAP et clôture du dossier
Persistance d’anomalies coronaires
si < 6 mm
AAP prolongé
Consultation
annuelle
si ≥ 6 mm
AAP et AVK à vie
Consultation
semestrielle
AAP : antiagrégant plaquettaire
ECG : électrocardiogramme
AVK : antivitamine K
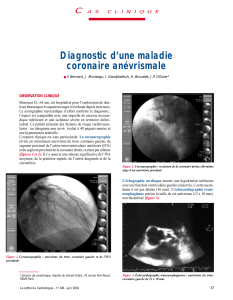
Figure 4
Echographie cardiaque : tronc commun
(TC) régulier puis anévrisme
Figure 5
Scanner cardiaque : anévrismes en
chapelet (flèches)
aorte
aorte
➝
➝
anévrisme
TC

EXAMENS
COMPLÉMENTAIRES
ET ÉVOLUTION
L’échographie est l’examen le plus fiable
et le plus sensible pour détecter les ané-
vrismes coronaires à la phase aiguë et
subaiguë. On préconise un suivi par un
électrocardiogramme (ECG) et une
échographie cardiaque, initialement
hebdomadaires (figures 3 et 4). Les ané-
vrismes coronaires surviennent le plus
souvent entre le dixième et le vingt-cin-
quième jour d’évolution [1].
Il n’y a pas d’indication à contrôler le bi-
lan sanguin lors du suivi si l’enfant re-
trouve un état clinique satisfaisant dans
les semaines qui suivent le diagnostic.
En effet, l’inflammation biologique peut
durer jusqu’à soixante-dix jours. Le bilan
sera donc perturbé de façon prolongée.
Si un enfant pour lequel un diagnostic
de Kawasaki a été fait ne retrouve pas
un état général satisfaisant dans les
deux mois qui suivent le diagnostic, un
bilan à la recherche d’un diagnostic dif-
férentiel doit être envisagé (arthrite ju-
vénile, maladie de système…).
Enfin, dans les formes graves, le cathété-
risme cardiaque est toujours indiqué
pour faire un bilan complet des lésions.
On peut aussi observer des anévrismes
sur les axes artériels des membres, sou-
vent de façon symétrique (artère axillai-
re, humérale, radiale, fémorale, iliaque),
Médecine
& enfance
et sur les artères abdominales, en parti-
culier les mésentériques supérieure et in-
férieure, avec éventuellement un infarc-
tus mésentérique. Les atteintes des ar-
tères rénales sont plus rares et des caro-
tides exceptionnelles.
La maladie comprend trois phases : la
phase aiguë (J0-J10), où l’atteinte car-
diaque est rare ; la phase subaiguë (J10-
J20), où le diagnostic de complication
coronaire est le plus fréquent ; la phase
de convalescence (J20-J70), où l’on
peut voir des anévrismes et/ou des sté-
noses cicatricielles. Lorsque les ané-
vrismes sont de grande taille (plus de
8 mm), ils peuvent ne pas régresser.
Sur le plan cardiaque, le risque de lé-
sion coronaire est de moins de 5 % chez
les enfants traités précocement. Il existe
différents types de lésions ; les deux
principaux sont les dilatations coro-
naires (2,3 %) et les anévrismes (1 %),
mais on observe aussi des anomalies
valvulaires, des anévrismes géants, des
sténoses coronaires et des infarctus [10].
Le suivi à long terme est établi selon
une stratification du risque [1]. On peut
être amené à faire un scanner cardiaque
(figure 5) ou une coronarographie en cas
d’atteinte coronaire. Finalement, la
question d’un risque augmenté de mala-
die coronaire à l’âge adulte reste discu-
tée. Les anomalies histologiques vascu-
laires dans la maladie de Kawasaki sont
différentes de celles de l’athérosclérose.
Cependant, il existe une moindre capa-
cité de vasodilatation des artères coro-
naires (dysfonction endothéliale), mê-
me chez les enfants sans atteinte coro-
naire initiale. Les études de la prochai-
ne décennie devraient donner des ré-
ponses plus claires, d’autant que les pre-
miers patients ont désormais atteint
l’âge de l’athérosclérose. Actuellement,
il faut être rassurant avec les parents,
surtout avec ceux dont les enfants n’ont
pas eu de lésion coronaire ou qui ont eu
des lésions régressives, tout en préconi-
sant une prévention des facteurs de
risques cardiovasculaires à l’âge adulte.
CONCLUSION
La maladie de Kawasaki est le plus sou-
vent bénigne, mais elle peut être grave
lorsqu’il y a une atteinte coronaire irré-
versible. Heureusement, cela est devenu
exceptionnel depuis qu’elle est traitée de
manière précoce et efficace par les im-
munoglobulines. La prise en charge est
très standardisée. Les complications car-
diovasculaires doivent être recherchées
systématiquement. L’information des
parents sur la maladie de Kawasaki est
spécifique. Elle permet d’éviter une an-
goisse parentale prolongée, surtout
lorsque les artères coronaires sont nor-
males après le premier mois d’évolution.
La priorité reste la mise au point d’un
test diagnostique fiable, élément essen-
tiel pour la recherche en génétique et en
thérapeutique.
첸
mars 2013
page 75
Références
[1] NEWBURGER J.W., TAKAHASHI M., GERBER M.A. ET AL. ;
COMMITTEE ON RHEUMATIC FEVER, ENDOCARDITIS AND
KAWASAKI DISEASE ; COUNCIL ON CARDIOVASCULAR DI-
SEASE IN THE YOUNG ; AMERICAN HEART ASSOCIATION ;
AMERICAN ACADEMY OF PEDIATRICS : « Diagnosis, treat-
ment, and long-term management of Kawasaki disease : a state-
ment for health professionals from the Committee on Rheumatic
Fever, Endocarditis and Kawasaki Disease, Council on Cardio-
vascular Disease in the Young, American Heart Association »,
Circulation,
2004 ;
110 :
2747-71.
[2] UEHARA R., BELAY E.D. : « Epidemiology of Kawasaki disease
in Asia, Europe, and the United States »,
J. Epidemiol.,
2012 ;
22 :
79-85.
[3] BURGNER D., HARNDEN A. : « Kawasaki disease : what is the
epidemiology telling us about the etiology ? »,
Int. J. Infect. Dis.,
2005 ;
9:
185-94.
[4] WANG C.L., WU Y.T., LIU C.A. et al. : « Kawasaki disease : in-
fection, immunity and genetics »,
Pediatr. Infect. Dis. J.,
2005 ;
24 :
998-1004.
[5] LEUNG D.Y., COTRAN R.S., KURT-JONES E. et al. : « Endothe-
lial cell activation and high interleukin-1 secretion in the pathoge-
nesis of acute Kawasaki disease »,
Lancet,
1989 ;
2:
1298-302.
[6] KUO H.C., YANG K.D., CHANG W.C. et al. : « Kawasaki disea-
se : an update on diagnosis and treatment »,
Pediatr. Neonatol.,
2012 ;
53 :
4-11.
[7] MONAGLE P., CHAN A.K., GOLDENBERG N.A. et al. : « Anti-
thrombotic therapy in neonates and children : Antithrombotic
Therapy and Prevention of Thrombosis, 9th ed : American Colle-
ge of Chest Physicians Evidence-Based Clinical Practice Guide-
lines »,
Chest,
2012 ;
141 (suppl. 2) :
e737S-801S.
[8] MUTA H., ISHII M., YASHIRO M. et al. : « Late intravenous im-
munoglobulin treatment in patients with Kawasaki disease »,
Pe-
diatrics,
2012 ;
129 :
e291-7.
[9] OGATA S., OGIHARA Y., HONDA T. et al. : « Corticosteroid
pulse combination therapy for refractory Kawasaki disease : a
randomized trial »,
Pediatrics,
2012 ;
129 :
e17-23.
[10] FUKAZAWA R. : « Long-term prognosis of Kawasaki disease :
increased cardiovascular risk ? »,
Curr. Opin. Pediatr.,
2010 ;
22 :
587-92.
1
/
4
100%