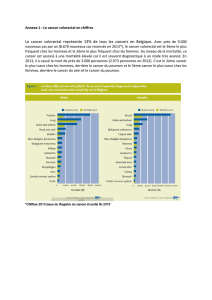
Dépistage des tumeurs colorectales par les tests moléculaires

Pourquoi le dépistage ?
La coloscopie est l’examen qui permet de faire le diagnostic formel du cancer co-
lique ainsi que celui des lésions précancéreuses que sont les polypes adénomateux.
Toutefois, il est impossible de faire pratiquer cet examen régulièrement à tout sujet
à risque moyen (âgé de plus de 45 ans dans la population générale). En effet, mal-
gré sa sensibilité supérieure à 95 % pour la détection des tumeurs malignes et des
adénomes de plus d’un centimètre de diamètre, et une spécificité supérieure à 99 %,
la coloscopie nécessite une préparation, la plupart du temps une anesthésie géné-
rale, un coût économique exorbitant, et de rares complications. À l’échelle d’une
population, ces dernières représenteraient un volume non négligeable, difficilement
acceptable au plan éthique et économique pour un examen de dépistage (1-6). Pour
cette raison, une action de dépistage se déroule en deux étapes : un examen de sé-
lection (ou de dépistage) et un examen diagnostique. Un test de dépistage doit être
simple, non coûteux et non invasif. Il est conçu comme marqueur biologique iden-
tifiable dans les effluents biologiques : selles, sang, urines. À l’heure actuelle les tests
sont basés sur la détection du sang dans les selles.
Limites du dépistage par la recherche de sang dans les selles
La recherche d’un saignement occulte dans les selles à titre de dépistage est à ce jour
la seule approche validée dans le dépistage de masse organisé du cancer du côlon.
Une stratégie, combinant la recherche de sang occulte dans les selles suivie de co-
loscopie en cas de recherche positive, est proposée aux sujets à risque moyen et a
démontré son impact sur la mortalité par cancer colique (voir le premier et le
deuxième chapitre).
Toutefois, la faible sensibilité de ces tests estimée entre 25 et 50 % en constitue
la limite : moins de 50 % des cancers en moyenne, et seulement 20 % des adénomes
Dépistage des tumeurs colorectales par
les tests moléculaires
I. Sobhani et M. Abolhassani

de plus d’un centimètre sont dépistés (7-10). La valeur prédictive positive d’un gros
polype ou d’un cancer invasif ne dépasse pas 18,5 % dans l’étude française (11-12).
La recherche et le développement de nouvelles méthodes de dépistage du cancer co-
lorectal, plus sensibles que le test d’Hemoccult, sont donc indispensables.
Tests alternatifs à la recherche fécale de sang
Chaque jour, 1010 cellules coliques sont exfoliées. Bien que la (ou les) tumeur(s)
colique(s) n’occupe(nt) pas plus de 1 % de la surface de la muqueuse (exception
faite de la polypose familiale), il semble que 14 à 24 % (2, 13) des cellules libérées
dans la lumière intestinale soient d’origine tumorale. Il est donc possible de cibler,
parmi ces cellules exfoliées, celles provenant d’une tumeur. Ce type d’approche est
déjà adopté pour la mise en évidence de cellule dysplasique par technique immu-
nologique ou moléculaire (tableau I). Les tests immunologiques encore trop préli-
minaires basés sur la détection de mucines anormalement glycosylées, ou de
cytokératines particulièrement exprimées par les cellules néoplasiques, ou de pep-
tides (vimentine, ACE, etc.) surexprimées par ces cellules n’ont pas été validés et
leur spécificité et stabilité posent encore des problèmes techniques (14-16). À l’in-
verse, la mise en évidence d’ARN ou d’ADN anormaux est davantage étudiée dans
différents effluents biologiques et en particulier dans les selles.
Tableau I - Dépistage de tumeurs colorectales par marqueurs fécaux.
Détection de colonocytes et/ou de constituants spécifiques de tumeur
(Technique immunologique)
Mucines, peptides, antigènes tumoraux
M2-pyruvate kinase, ACE (37, 38)
Surexpression d’oncogènes
ARNm des gènes de cyclooxygénase, cycline D1 (29)
Détection d’ADN humain
DNA total (14 % d’origine tumorale)
DNA long (non apoptotique)
Perte d’hétérozygotie
Altération de séquence (instabilité microsatellitaire ; mutation spécifique)
Modification épigéniques (hyperméthylation des gènes)
44 Le dépistage du cancer colorectal

Test fécal de détection d’ADN altéré
Différentes techniques d’extraction d’ADN à partir des selles ont été mises au point.
L’ADN humain dans les selles représente 100 ng/g, ce qui correspond à environ
0,01 % d’ADN fécal total, le reste étant représenté par l’ADN d’origine bactérienne
et alimentaire. Il est donc important de prévoir une première phase d’enrichisse-
ment d’ADN d’origine humaine avant de procéder à une amplification d’une ano-
malie de séquence par la technique de PCR. De plus, il existe d’importants
inhibiteurs d’amplification dans les selles. Ces deux problèmes techniques sont
maintenant résolus.
La quantité d’ADN isolée à partir des selles est quatre à cinq fois supérieure chez
les patients avec cancer invasif que chez les patients sans tumeur colique (5). Le
schéma classique allant de « muqueuse normale », à « cancer invasif », en passant
par la constitution de « crypte aberrante » et polype « adénomateux » reste le schéma
physiopathogénique de référence (fig. 1). Cette filiation vers le cancer dépend du
temps et s’étale en général sur dix à vingt ans. Cette durée est raccourcie en fonc-
tion de l’importance des risques héréditaires ou environnementaux.Différentes ano-
malies d’ADN surviennent à des stades successifs : des mutations du gène APC et
Dépistage des tumeurs colorectales par les tests moléculaires 45
Fig. 1 - Schéma physiopathologique de la carcinogenèse colique. À l’expression phénotypique
tissulaire qui comporte des étapes allant de la muqueuse normale au cancer invasif, en pas-
sant par le crypte aberrant, le polype adénomateux de petite et de grande taille (>1 cm de dia-
mètre), on peut faire correspondre des expressions phénotypiques endoscopiques. Il est
important de noter que les tests actuels de recherche de sang occulte dans les selles ne détec-
tent au mieux que les lésions les plus avancées alors que le test moléculaire fécal basé sur la
mise en évidence d’ADN altéré dans les selles couvre un spectre plus large de lésions en
recherchant des anomalies géniques au niveaux des gènes d’APC, K-ras, p53 et ceux impli-
qués dans la réparation des mésappariements d’ADN.

K-ras au stade de crypte aberrante et polypes adénomateux, des anomalies d’appa-
riement d’ADN sont identifiées par analyse de microsatellites instables au stade d’in-
vasion tumorale, etc. L’ADN est relativement stable dans les selles et des mutations
ponctuelles ont déjà été rapportées dans les selles des patients atteints de cancer ou
porteurs d’adénomes coliques (2, 17-18). Par opposition aux tests basés sur la pré-
sence de sang dans les selles, l’ADN altéré est toujours d’origine tumorale, et est li-
béré dans la lumière colique de façon régulière du fait du renouvellement cellulaire.
Les limites de cette technique sont d’une part, les conditions d’optimisation du ren-
dement de récupération d’ADN tumoral et d’autre part, l’absence d’un marqueur
moléculaire unique du fait de l’hétérogénéité des tumeurs. Par exemple, la muta-
tion K-ras, n’est présente que dans moins de 50 % des tumeurs. Ce sont donc des
tests de mise en évidence d’altérations multiples qui offriraient une alternative rai-
sonnable à l’Hémocult II. Parmi ces anomalies, la plus fréquente et la plus simple à
identifier est l’ADN hautement amplifiable (appelé long ADN, L-ADN). Il faudra
sans doute associer à ce marqueur un panel d’anomalies moléculaires incluant celles
bien connues des gènes K-ras, p53, APC ou Bat 26 (marqueur d’instabilité de
microsatellite) ou encore la recherche d’anomalies moins connues de l’ADN
méthylé de plusieurs gènes pour pouvoir détecter un plus grand nombre de tumeurs.
Extraction de l’ADN tumoral
La mise en évidence de l’ADN tumoral à partir d’un effluent biologique nécessite
l’extraction et la purification de l’ADN total et des procédés d’enrichissement de la
sous-fraction d’origine tumorale. Les selles constituent le premier réservoir d’ADN
d’origine tumorale colique ou rectale. Elles contiennent en plus des quantités im-
portantes d’ADN d’origine animale et végétale, issu de l’alimentation et de l’ADN
bactérien. Les méthodes d’extraction d’ADN tumoral nécessitent le recueil d’un vo-
lume important de selles avec une purification d’ADN basée sur la capture d’ADN
par hybridation et souvent une amplification des segments d’ADN (19).
Généralement, les selles sont émises à température ambiante et rapidement mises
dans une solution tampon qui doit favoriser l’extraction d’ADN d’origine humaine.
Selon le test commercialisé (EXACT), le rapport de dilution est de 1 g de selles pour
10 ml de solution de tampon, une quantité minimale de 5 g de selles semble indis-
pensable. Après une centrifugation à 37°C, le surnageant est recueilli dans du tam-
pon Tris saturé en phénol et chloroforme. Les acides nucléiques sont ensuite
précipités (1/10 volume) dans l’isopropanol et l’acétate de sodium. Après centrifu-
gation, les acides nucléiques sont suspendus dans un tampon Tris enrichi en EDTA
et ARNase.
La qualité des ADNs purifiés doit être vérifiée par spectrophotométrie et élec-
trophorèse sur gel d’agarose avant et après traitement par de l’ARNase (fig. 2).
Taille de l’ADN
Les cellules qui échappent à l’apoptose (c’est souvent le cas des cellules tumorales
ou des colonocytes normaux dans le contexte de colite inflammatoire) possèdent
46 Le dépistage du cancer colorectal

des fragment d’ADN plus longs que ceux habituellement retrouvés dans une cellule
normale. L-ADN ou l’ADN long (fragment d’ADN fécal supérieur à 200 kb) de-
vrait donc être un premier marqueur approximatif de tumeur colorectale. Toutefois,
sa faible sensibilité dans les conditions habituelles de recueil et d’acheminement des
selles (à température ambiante) en a réduit l’intérêt (20). Il est probable qu’une col-
lection des selles sur glace et un acheminement à température inférieure à 10°C ré-
duisent la dégradation du L-ADN. Toutefois, le temps d’acheminement des selles,
variable d’un sujet à l’autre, et le caractère parfois déshydraté des selles au moment
même de la défécation seront sans doute des limites à la généralisation de ce mar-
queur dans le contexte du dépistage.
Deux techniques sont actuellement disponibles pour la purification de l’ADN
d’origine tumorale, l’une passant par le procédé de capture d’ADN, l’autre ne né-
cessitant pas ce procédé. Le procédé de capture suppose une hybridation sur des
oligonucléotides dont la construction est basée sur des séquences prédéfinies, elles-
mêmes établies à partir de mutations spécifiques rapportées aux niveaux des gènes
impliqués dans la carcinogenèse colique (fig. 1). Ces séquences sont difficiles à stan-
dardiser compte-tenu des mutations hétérogènes rapportées d’une série à l’autre.
Notre expérience personnelle révèle que dans les conditions de recueil à tempéra-
ture ambiante et de conservation (4°C) et le délai court (24-48 h) de réception du
prélèvement, le rendement d’extraction d’ADN tumoral est bon sans la nécessité de
Dépistage des tumeurs colorectales par les tests moléculaires 47
Fig. 2 - Électrophorèse des ADNs extraits à partir des selles et du sang du même patient avant
(1) et après (2) traitement des prélèvements par de l’ARnase.
Ce protocole est disponible sur le site du fournisseur du kit utilisé (QIAamp DNA blood kit
de Qiagen).
*http://www1.qiagen.com/literature/handbooks/PDF/GenomicDNAStabilizationAndPurific
ation/FromClinicalSamples/QA_DNA_Stool_Mini/1018546_HBQAStoolmin_082001.pdf
**http://www1.qiagen.com/literature/handbooks/PDF/GenomicDNAStabilizationAndPurifi
cation/FromAnimalAndPlantIssues/GENO/1018833_HB_GENO_082001.pdf
{
{
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%