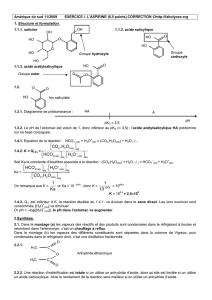
Solutions aqueuses 1 : réactions acides

Année universitaire 2014/2015
Université Joseph Fourier (UJF) Grenoble I - Tous droits réservés
Année universitaire 2014/2015
Université Joseph Fourier (UJF) Grenoble I - Tous droits réservés
Année universitaire 2014/2015
Université Joseph Fourier (UJF) Grenoble I - Tous droits réservés
Chapitre 6 :
Solutions aqueuses 1 : réactions
acides-bases
Dr. Pierre-Alexis GAUCHARD
UE1 : Chimie – Chimie physique

I. Préambule
II. Réactions acido-basiques
Chapitre 6.
Solutions aqueuses 1 :
réactions acides-bases
III. Titrages acido-basiques

I. Préambule
I.1) Solutions aqueuses
I.2) Evolution d’un système chimique

Une solution aqueuse s’obtient en dissolvant dans l’eau (qui constitue le
solvant) un ou plusieurs composés (appelés solutés).
Propriétés de l’eau solvant
Molécule polaire, moment dipolaire élevé
Constante diélectrique élevée (r= 80)
I.1) Solutions aqueuses
q’
r
q
Interaction de 2
charges de signe
opposé
Dans le vide…
Dans un solvant…
r= 2 pour le benzène, 4 pour l’éther, 20 pour l’acétone, 24 pour l’éthanol
i) l’eau solvant

I.1) Solutions aqueuses
ii) mise en solution de composés ioniques
1ère étape : solvatation du sel
effet solvatant (hydratant)
2ème étape : rupture des liaisons
ioniques
effet dissociant
3ème étape : solvatation des ions
effet solvatant (hydratant)
4ème étape : dispersion des ions
solvatés
effet dispersant
exemple : NaCl
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
1
/
48
100%