sujets memoire 2014_Duwez

Nanochimie et Systèmes Moléculaires
Prof. A.-S. Duwez
Sujets de mémoire
1. Etude de nano-architectures non conventionnelles: les oligorotaxanes
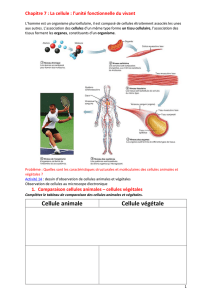
Les foldamères sont des architectures moléculaires synthétiques repliées, inspirées des structures et
fonctions des biopolymères naturels. Le repliement est un processus sélectionné par la nature pour
pouvoir réaliser des tâches chimiques ou mécaniques, comme la catalyse enzymatique, le stockage
d'information, la duplication des acides nucléiques, le transport,...
Etant donné que les repliements des biomolécules sous-tendent leur fonction, nous pouvons imaginer
qu'en conférant aux molécules synthétiques des structures secondaires repliées, un vaste éventail de
matériaux fonctionnels avec de nouvelles propriétés émergentes serait potentiellement accessible. La
synthèse de molécules artificielles adoptant des structures secondaires repliées est en effet un
domaine de recherche très actif et très riche ces dernières années.
Très récemment, une classe d'oligomères synthétiques se trouvant à l'intersection entre le domaine
des molécules mécaniquement entrelacées et les foldamères synthétiques a émergé: les
oligorotaxanes. Ce système est le tout premier à combiner un motif de repliement et une structure
entrelacée mécaniquement liée. La structure secondaire à l'état solide a été résolue par
cristallographie aux rayons X. Les caractéristiques structurales des molécules en solution ont été
étudiées par spectroscopie RMN. Cependant, la structure détaillée et la dynamique du système en
solution restent controversées et l'idée même d'une structure repliée en solution est un sujet à débat.
Nous proposons ici d'étudier des foldamères d'oligorotaxanes par spectroscopie de force AFM afin de
résoudre les études contradictoires (ou incomplètes) obtenues par des techniques d'ensemble, et
ainsi obtenir des informations détaillées sur la structure et les propriétés mécano-chimiques.
!"#
#
!
#
!"#$%&'('
'
'
'
'
'
!!
!!
!!
!!
!!
!!
!!
!!
!!
!!
!!
!!
!!
!!
!!
!!
"
"""
"
"
"""
"
"
"""
"
"
"""
"
"
"""
"
"
"""
"
"
"""
"
"""
#
#
#
#
""
#
#
#
#
""
#
#
#
#
""
#
#
#
#
""
#
#
#
#
""
#
#
#
#
""
#
#
#
#
""
#
##
"
"
"
$
$
""""""""" " "" " "" " """""
"
"""
#
#
#
#
"
#
#
#
"
"
"$$
!!
!!
!!
!!
!!
!!
!!
!!
!!
!!
!!
!!
"
"""
"
"""
"
"
"""
"
"
"""
"
"
"""
"
"
"""
"
"""
#
#
#
#
""
#
#
#
#
""
#
#
#
#
""
#
#
#
#
""
#
#
#
#
""
#
#
#
#
"
#
##
"
"
"
$
$
""""""""" " "" " ""
#
#
#
"
"
"$$
!!
!!
!!
!!
!!
!!
"
"""
"
"""
"
"
"""
"
"""
#
#
#
#
""
#
#
#
#
""
#
#
#
#
"
#
##
"
"
"
$
$
""""""
#
#
#
"
"
"$$
!!
!!
!!
!!
!!
!!
!!
!!
"
"""
"
"""
"
"
"""
"
"
"""
"
"""
#
#
#
#
""
#
#
#
#
""
#
#
#
#
""
#
#
#
#
"
#
##
"
"
"
$
$
"""""""""
#
#
#
"
"
"$$
!!
!!
!!
!!
"
"""
"
"""
"
"""
#
#
#
#
""
#
#
#
#
"
#
##
"
"
"
$
$
"""
#
#
#
"
"
"$$
!!
!!
"
"""
"""
#
#
#
#
"
#
##
"
"
"
$
$
#
#
#
"
"
"$$
'
!"#$%&')'
observations, we can infer the following empirical selection
rule: the most stable co-conformation
38
in any of the oligorotaxanes
will be one in which no two CBPQT
4+
rings reside on adjacent DNP
sites. This rule simultaneously explains the presence of multiple
translational isomers in the Confused series and the line
broadening observed in the Frustrated series, since multiple co-
conformations can be identied to satisfy the rule in the former,
while no translational isomers will satisfy the selection rule in
the case of the latter. Thus, we use the term Confused to imply a
rotaxane that expresses multiple stable translational isomers
that are slow to equilibrate on the
1
H NMR timescale. A Frus-
trated rotaxane, on the other hand, equilibrates more rapidly
between multiple higher-energy states. It seems that the Happy
series exhibits a ‘Goldilocks’
39
effect, where the number of rings
and recognition units are perfectly matched so as to make a
single ‘happy’translational isomer far more stable than any
alternative. These anthropomorphic concepts are illustrated
graphically using the 7NP oligorotaxanes (the smallest set we
isolated with members in all three ‘moods’) as examples in
Fig. 2. A selection rule that forbids the CBPQT
4+
rings to encircle
adjacent DNP sites also agrees well with a secondary structure
that is stabilized by continuous D–A–D–A stacking, as
observed
21
in the donor–acceptor pseudorotaxanes with 50%
recognition-site occupancy in the solid state.
Although the Confused oligorotaxanes adopt multiple trans-
lational isomers, the species with the longest D–A stacking
motif will be the most highly stabilized and therefore the
dominant isomer. In the simplest Confused rotaxane [2]3NPR
4+
,
for example, the most stable translational isomer –that with the
CBPQT
4+
ring encircling the central DNP unit –is adopted by
80% of the molecular population (see Section 3B of the ESI†).
The remaining 20% of the molecules adopt a co-conformation
with the CBPQT
4+
on the periphery, where the stabilizing D–A
interactions are inevitably weaker on account of the ring's
access to half as many ‘alongside’DNP units. This 4 : 1 distri-
bution indicates that there is only a small difference between
the free energies (<1 kcal mol
!1
) of the various rule-compliant
isomers of the Confused oligorotaxanes. There is no indication
that Happy oligorotaxanes are signicantly more stabilized than
the dominant Confused rotaxanes, however, despite the bias in
favor of Happy oligorotaxanes in the product distributions.
Rather, the preference for Happy oligorotaxanes during the
stoppering protocol is most likely a result of using CBPQT
4+
in
nearly 1 : 1 stoichiometry with the DNP recognition units,
which amounts to an excess with respect to the half-occupancy
foldamers. Indeed, the entropic penalty for adding more rings
onto the dumbbells of Happy rotaxanes may compete with the
enthalpic gains earned from the extra D–A interactions enabled
by the BIPY
2+
units of the terminal cyclophanes. In any event,
only the Happy family of oligorotaxanes (Fig. 3) are conducive to
detailed solution-state analysis by high eld
1
H NMR
Fig. 2 A Goldilocks effect in donor–acceptor oligorotaxanes, exemplified by the
7NP-based compounds. The [0.5(n!1) + 1]rotaxane [4]7NPR
12+
has up to six
translational isomers that satisfy the selection rule forbidding CBPQT
4+
rings to
encircle adjacent DNP sites, eliciting the ‘Confused’designation. On the other
hand, it is impossible to draw a structure that obeys the rule for the [0.5(n!1) +
3]rotaxane [6]7NPR
20+
, hence it is ‘Frustrated’. Only the [0.5(n!1) + 2]rotaxane
[5]7NPR
16+
has a single ‘Happy’translational isomer that satisfies the rule.
Fig. 3 Molecular structures of the oligomers in the Happy series of donor–acceptor oligorotaxanes.
This journal is ªThe Royal Society of Chemistry 2013 Chem. Sci.,2013,4,1470–1483 | 1475
Edge Article Chemical Science
Downloaded by Universite De Liege on 17/04/2013 14:48:12.
Published on 04 February 2013 on http://pubs.rsc.org | doi:10.1039/C3SC00015J
View Article Online
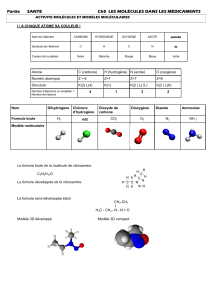
2. Etude de nano-architectures hélicoidales non conventionnelles: les foldamères
oligoamide aromatiques
Les foldamères sont des architectures moléculaires synthétiques repliées, inspirées des structures et
fonctions des biopolymères naturels. Le repliement est un processus sélectionné par la nature pour
pouvoir réaliser des tâches chimiques ou mécaniques, comme la catalyse enzymatique, le stockage
d'information, la duplication des acides nucléiques, le transport,...
Etant donné que les repliements des biomolécules sous-tendent leur fonction, nous pouvons imaginer
qu'en conférant aux molécules synthétiques des structures secondaires repliées, un vaste éventail de
matériaux fonctionnels avec de nouvelles propriétés émergentes serait potentiellement accessible. La
synthèse de molécules artificielles adoptant des structures secondaires repliées est en effet un
domaine de recherche très actif et très riche ces dernières années.
Récemment, des architectures moléculaires hélicoidales ont pu être produites à partir d'un squelette
oligoamide aromatique. La structure exacte est bien caractérisée en phase solide, mais très peu de

choses sont connues quant au comportement dynamique en solution. Dans le cadre de ce mémoire,
nous étudierons par spectroscopie de force AFM différents foldamères de longueur variable, dans
différents solvants afin de moduler les interactions intramoléculaires responsable de la structure
hélicoidale.
3. Etude des mécanismes de dissociation de séquences d’ADN en présence de
ligands.
De courtes séquences d’ADN sont continuellement sujettes à la séparation en simple brins dans les
processus cellulaires de transactions génomiques (transcription, réplication, …). La liaison de petits
ligands à ces séquences peut affecter ces mécanismes vitaux. Bien que la recherche de molécules se
liant à des séquences spécifiques soit en plein essor, avec des applications prometteuses dans les
domaines de diagnostic et thérapeutique biomédicale, l’effet exact de ces ligands sur la séparation de
la double hélice en simple brins reste peu connu. Ce travail contribuera à une meilleure
compréhension du comportement de dissociation d’un complexe stable ligand-ADN sous une force.
Nous utiliserons la spectroscopie de force sur molécule unique, basée sur l'AFM, pour mesurer les
forces de rupture d'un court duplexe et de ses complexes avec un ligand du petit sillon et un
intercalant.
5’-GGT AAA TTT AGG-3’
5'-CCT AAA TTT ACC-3'
5'-HS(CH2)6-T24-3'
a b
c
Figure 1

4. Reconnaissance moléculaire entre peptides et surfaces inorganiques
La biomimétique moléculaire est une science émergente qui vise à reproduire artificiellement des
propriétés essentielles d'un ou plusieurs systèmes biologiques. Elle exploite les mécanismes de la
nature pour les appliquer dans différents domaines technologiques. Ces dernières années, on
constate un engouement pour la biomimétique dans la science des matériaux en vue de développer
de nouvelles applications inspirées de la nature et non envisageable jusqu’alors par les technologies
classiques.
La technologie GEPI se base sur des peptides conçus par génie génétique, capables de fixer
spécifiquement un composé inorganique. Outil de base de la biomimétique moléculaire, le GEPI est
utilisé comme module de construction pour diriger l’assemblage hiérarchisé, à l’échelle moléculaire,
de matériaux hybrides (organique/inorganique) avec un contrôle sur la composition et la forme.
Il existe entre autres des GEPIs capables de lier les métaux nobles (Au, Pt, Pd, Ag), les oxydes
métalliques (SiO2, ZnO, TiO2), les semi-conducteurs (GaAs, ZnS), … Le GEPI a une spécificité
élevée: il peut par exemple distinguer deux oxydes différents voire même des structures cristallines
différentes d’un même composé.
Dans le cadre de ce mémoire, nous grefferons différents GEPIs sur des pointes AFM et nous
évaluerons leur capacité à reconnaître une surface pour laquelle ils ont été optimisés via la mesure
des forces d'interactions entre la pointe et la surface. Les séquences des acides aminés du GEPI
seront modifiées (changement de la position d'un acide aminé, remplacement d'un acide aminé) afin
d'évaluer l'impact de changements mineurs sur le potentiel de reconnaissance.
5. En fonction des souhaits des étudiants, ces sujets peuvent être adaptés, d'autres
proposés.
1
/
3
100%