TABLE DES MATIERES

iii
TABLE DES MATIERES
LISTE DES ABBREVIATIONS.....................................................................................................i
TABLE DES MATIERES.............................................................................................................iii
RESUME................................................................................................................................... - 1 -
INTRODUCTION..................................................................................................................... - 2 -
1 Les cellules dendritiques au sein de la réponse immune........................................................- 2 -
1.1 L'immunité innée et adaptative .........................................................................................................- 2 -
1.2 Les sous-populations de cellules dendritiques ..................................................................................- 4 -
1.3 La génération des cellules dendritiques.............................................................................................- 4 -
1.4 Les fonctions des cellules dendritiques.............................................................................................- 5 -
2 Reconnaissance des pathogènes par les "pattern recognition receptors" de signalisation- 13 -
2.1 Les récepteurs de la famille Toll Like.............................................................................................- 13 -
2.2 Les récepteurs cytosoliques.............................................................................................................- 18 -
3 La famille des IRFs (interferon regulatory factors)............................................................- 22 -
3.1 Structure et expression des IRFs.....................................................................................................- 22 -
3.2 Activation des IRFs.........................................................................................................................- 23 -
3.3 Les fonctions biologiques des IRFs.................................................................................................- 26 -
4 Les cytokines de la famille de l'interleukine 12....................................................................- 33 -
4.1 Les sources cellulaires.....................................................................................................................- 33 -
4.2 Les récepteurs et leur signalisation .................................................................................................- 35 -
4.3 Les fonctions biologiques................................................................................................................- 36 -
4.4 La régulation transcriptionnelle.......................................................................................................- 43 -
BUT DU TRAVAIL................................................................................................................. - 47 -
RESULTATS........................................................................................................................... - 48 -
1 Implication d'IRF3 dans l'activation du gène de l'IL-12p35 induite par TLR4 et TLR3 - 48 -
2 La synthèse d'IL-27 induite en réponse à l'engagement de TLR4 dépend de manière
critique d'IRF3.................................................................................................................................- 57 -
3 Le rôle du complexe ISGF3 dans l'expression du gène de l'IL-27p28 induite par les TLRs
révèle un mécanisme d'activation transcriptionnelle en deux étapes..........................................- 68 -
DISCUSSION ET PERSPECTIVES ................................................................................... - 114 -

iv
1 Modèles de régulation transcriptionnelle des cytokines de la famille de l'IL-12.............- 114 -
1.1 Régulation transcriptionnelle de l'IL-12........................................................................................- 114 -
1.2 Régulation transcriptionnelle de l'IL-23........................................................................................- 117 -
1.3 Régulation transcriptionnelle de l'IL-27........................................................................................- 118 -
1.4 Régulation différentielle de l'IL-12, IL-23 et IL-27......................................................................- 121 -
2 Implication de l'axe IFNβ/IL-27 dans les réponses antivirales.........................................- 124 -
3 Importance de l'axe IFNβ/IL-27 dans les maladies autoimmunes....................................- 126 -
4 Implication dans l'immaturité du système immunitaire néonatal....................................- 128 -
4.1 Production des cytokines de la famille de l'IL-12 par les cellules dendritiques néonatales. .........- 128 -
4.2 Implications pour les stratégies vaccinales....................................................................................- 129 -
BIBLIOGRAPHIE................................................................................................................ - 131 -

- 1 -
RESUME
Les cellules dendritiques sont les sentinelles du système immunitaire. Elles sont
disséminées dans la plupart des tissus et organes et sont capables de détecter la
présence de pathogènes. La perception des signaux de danger se fait notamment grâce à
la présence de récepteurs de la famille Toll (TLRs). Deux voies de signalisation, qui
reposent sur l'activation des molécules adaptatrices MyD88 ou TRIF, peuvent être
induites par l’engagement de ces récepteurs par leur ligand. Ces voies de signalisation
mènent à l’activation de différents facteurs de transcription nécessaires à la production
de cytokines telles que les membres de la famille de l’interleukine-12 (IL-12).
La famille de l’IL-12 comprend quatre cytokines hétérodimériques: l’IL-12 (p35/p40),
l’IL-23 (p19/p40), l’IL-27 (p28/EBI3) et l’IL-35 (p35/EBI3). Chacune de ces cytokines
possède des fonctions bien définies et parfois complexes qui sont essentielles pour
l’établissement des réponses immunes innées et adaptatives mais également pour
l'atténuation de ces réponses limitant ainsi les effets délétères causés à l'organisme par
des réponses immunes excessives. La régulation transcriptionnelle de ces cytokines est
complexe puisque la présence des deux sous-unités est indispensable à leur production
par la cellule.
Dans le cadre de ce travail, nous avons étudié l'implication de facteurs de transcription
de la famille des IRFs dans l’induction des gènes codant pour les sous-unités qui
composent les cytokines de la famille de l'IL-12 en réponse à l’engagement des différents
TLRs. Le facteur de transcription IRF3 activé en aval de la voie TRIF dépendante joue un
rôle crucial dans la production des IFNs de type I et des réponses antivirales. Nos
résultats indiquent que ce facteur est également directement impliqué dans l'activation
des gènes codant pour les sous-unités p35 et p28. Par contre, ce facteur ne participe pas
au contrôle de l'expression de l'IL-12/23p40, l’IL-23p19 et d'EBI3. Nos observations
indiquent qu’IRF3 coopère avec d'autres membres de la famille des IRFs. En effet, IRF1
permet l'expression optimale des sous-unités p35 et p28 alors qu'IRF9 joue un rôle
essentiel dans le contrôle de l'expression de la p28, deux facteurs activés par la boucle
autocrine des IFNs de type I. Nos résultats indiquent donc qu’en réponse aux ligands
TLRs, l'expression des différentes sous-unités qui composent les cytokines de la famille
de l'IL-12 est régulée de manière différentielle et complexe. Les facteurs de transcription
de la famille des IRFs, de par leur implication dans le contrôle de l’expression de
certaines de ces sous-unités, participent à la balance entre ces différentes cytokines.

- 2 -
INTRODUCTION
1 Les cellules dendritiques au sein de la réponse immune
1.1 L'immunité innée et adaptative
L'organisme doit faire face à des infections par une grande variété de pathogènes et la
survie de l'hôte dépend de sa capacité à reconnaître l'agent infectieux et à induire une
réponse immunitaire appropriée. Le système immunitaire comprend l’ensemble des
cellules et des molécules qui nous protègent de tous ces dangers. Il est efficace grâce à
l'action coordonnée de la réponse innée caractérisée par sa rapidité et de la réponse
adaptative définie par sa spécificité.
Le premier mécanisme de défense du corps humain est constitutif et se compose des
épithélia, comme la peau et les muqueuses, qui sont des barrières physiques ayant pour
fonction d’empêcher l’invasion des pathogènes. De plus, certains peptides antimicrobiens
sont produits de manière constitutive par les cellules épithéliales. Des enzymes, telles
que le lysozyme et les défensines, sont ainsi présentes dans les fluides sécrétés comme
les larmes. Ces mécanismes sont présents au niveau des sites continuellement en
contact avec les microbes et leur capacité destructrice est strictement dirigée contre ces
microbes et non contre les cellules de l'hôte, grâce à leur présence dans des
compartiments bien définis ou à la nature de leur activité. Ces barrières ne sont
cependant pas infaillibles et il arrive que certains micro-organismes les traversent, par
exemple lors d’une lésion. La présence de l’agent pathogène au sein de l’organisme a
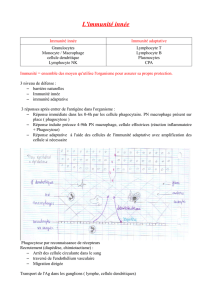
pour conséquence l’activation du système immunitaire. La réponse immune se déroule en
deux phases : dans un premier temps, la réponse innée et dans un second temps, la
réponse adaptative (Fig 1).
Lors de l’infection, l’agent pathogène est rapidement confronté aux effecteurs de la
réponse innée qui assure une protection de courte durée. Si l’infection persiste, la
réponse adaptative est induite. Cette dernière est générée plus lentement mais est plus
spécifique que la réponse innée et donne lieu au phénomène de mémoire, c’est-à-dire
que lors d’une seconde exposition par le même antigène, la réponse qui se développe
sera plus rapide et intense que la réponse initiale (Tableau 1).
Les effecteurs du système immunitaire inné peuvent être répartis en deux classes : les
facteurs solubles et les composants cellulaires.

- 3 -
Les facteurs solubles comprennent le complément qui est un ensemble de protéines
plasmatiques intervenant dans la lyse de certaines bactéries, l’activation de cellules
phagocytaires et l’opsonisation; les protéines de phase aigüe qui augmentent la
résistance à l’infection et induisent la réparation des tissus endommagés et une série de
chimiokines.
Les composants cellulaires comprennent les cellules polynucléaires (neutrophiles,
éosinophiles, basophiles, mastocytes), les cellules phagocytaires telles que les cellules
dendritiques (DCs), monocytes, macrophages qui internalisent les pathogènes alors
exposés à une série de molécules intracellulaires toxiques, et d’autres sous-types
cellulaires tels que les cellules T γδ, les cellules NK (Natural Killer) ou les cellules NKT
douées de propriétés cytotoxiques non spécifiques. L'activation de ces cellules nécessite
la reconnaissance du micro-organisme infectieux. La nature du pathogène est définie
grâce à des récepteurs génétiquement déterminés qui reconnaissent des structures
moléculaires communes aux micro-organismes, les PRRs (Pathogen Recognition
Receptor) 1.
A côté de leur rôle effecteur dans les réponses innées, les cellules dendritiques
permettent de lier l'immunité innée et adaptative de part leur propriété de cellules
présentatrices d'antigènes (APCs) 2. La réponse adaptative dépend des lymphocytes T et
B. Le récepteur porté par les lymphocytes T (T-cell receptor, TCR) et B (B cell receptor,
BCR) est le résultat d’un réarrangement somatique des gènes des segments V, D et J 3.
Ce mécanisme aléatoire de génération de récepteurs permet la formation d'un répertoire
caractérisé par une grande diversité cependant ces récepteurs ne sont pas capables de
déterminer la nature du pathogène 1. Les lymphocytes B reconnaissent l’antigène dans sa
conformation native et répondent aux stimuli antigéniques par leur division et leur
différenciation en plasmocytes qui sécrètent les anticorps. Les lymphocytes T, quant à
eux, reconnaissent uniquement des peptides dérivés des protéines antigéniques logés
dans une molécule du complexe majeur d’histocompatibilité (CMH) présent à la surface
des APCs 4. L'engagement du TCR induit l'expansion clonale des lymphocytes T et leur
différenciation en lymphocytes T effecteurs. La nécessité d'une expansion clonale et
d'une différentiation des cellules naïves spécifiques de l'antigène en cellules effectrices
avant de pouvoir contribuer aux défenses de l'hôte explique le délai observé lors de la
mise en place de la réponse adaptative ainsi que l'importance d'une première ligne de
défense rapide médiée par la réponse innée.
 6
6
1
/
6
100%