Un les code postal pour enzymes lysosomales - iPubli

SYNTHÈSE
Professeur agrégé
Stagiaire de recherche
Stagiaire de recherche
ADRESSE -
Un
les code postal pour
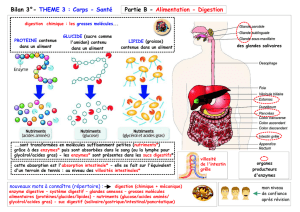
enzymes lysosomales
L

1
1


RÉFÉRENCES

 6
6
 7
7
 8
8
1
/
8
100%