Corrosion Humide du Fer : TP de Chimie

THEME 1 : LES MATERIAUX CHAP.1 CYCLE DE VIE DES MATERIAUX (CHAP.7 DU LIVRE)
Ch1 –Act 2 TP Corrosion - 1/6
ACT. 2 : TP : CORROSION HUMIDE DU FER
Mots-clés : corrosion, protection
Document 1. La corrosion désigne l'ensemble des phénomènes par lesquels un métal ou un alliage métallique tend à s'oxyder sous
l'influence de réactifs gazeux ou en solution. Elle est dite sèche lorsque les agents oxydants ne sont
pas en solution; elle est dite humide, dans le cas contraire. La corrosion des métaux est dans la
grande majorité des cas une réaction d’oxydo-réduction (échange d’électron(s) entre l’oxydant d’un
couple et le réducteur d’un autre couple).
Les exemples les plus connus sont la rouille du fer et de l'acier ou la formation de vert-de-
gris sur le cuivre et ses alliages (bronze, laiton). Cependant, la corrosion est un domaine bien plus
vaste qui touche toutes sortes de matériaux (métaux, céramiques, polymères) dans des
environnements variables (milieu aqueux, atmosphère, hautes températures). Ce phénomène pose
de graves problèmes tant sur le plan économique qu'industriel : le cas du fer est assez significatif, il
s'agit en effet du métal le plus utilisé dans l'industrie sous forme de fontes ou d'aciers. A part des
aciers spéciaux, dit inoxydables, tous les composés du fer sont corrodés. A la suite de plusieurs
réactions d’oxydo-réductions, l’oxydation du fer donne la rouille. Cette réaction est à l’origine de
dégâts importants car la rouille qui remplace le fer est très friable et fragilise grandement les
matériaux. (Term S Spécialité Bordas p.132)
Document2. « L’Erika était bien un navire poubelle ! Le naufrage du pétrolier maltais Erika le 12 décembre 1999 aux larges de
côtes bretonnes est imputable à une défaillance de la structure du navire provoquée par la corrosion et une insuffisance
d’entretien. » (La libre Belgique 19/12/2000)
Document 3.« 20 % de la production de fer ne sert qu’au remplacement du fer corrodé. Chaque seconde, ce sont quelque 5
tonnes d'acier qui sont ainsi transformées en oxydes de fer…» (Term S Spécialité Hatier p.108)
1. Quels sont les transformations chimiques mises en jeu lors de la corrosion du fer (formation de
ROUILLE) ?
Quels sont les REACTIFS mis en jeu ? Compétence APP
A l’aide des animations et des résultats ci-dessous, lister les réactifs qui interviennent dans le phénomène de corrosion
humide du fer.
Expérience 1 :
air + fer + eau
Expérience 2 :
diazote + fer + eau
Expérience 3 :
dioxygène + fer +
eau
Expérience 4 :
air + eau
Expérience 5 :
air + fer + huile
Laine de fer
rouillée ?
Oui
non
oui
non
non
Hauteur d’eau dans
l’éprouvette
1/5
0
totalité
0
0
Conclusion :
Les réactifs qui interviennent dans la formation de la rouille sont le fer, l'eau et l'air (dioxygène
gazeux puis aqueux).
Quelles sont les transformations chimiques liées à la corrosion? Compétence REA
1. Ecrire l'équation de réaction entre le fer et le dioxygène dissous.
Données: couples rédox concernés :
2
(aq)
Fe
/ Fe(s) et O2(aq)/
(aq)
HO
. Remarque importante : milieu basique
Explication pour écrire l’équation de la réaction : (sur le brouillon)
J’écris la demi-équation électronique correspondant à chaque couple en soulignant les réactifs :
Fe2+(aq) / Fe(s) Fe2+(aq) + 2 e- Fe(s)
O2(aq) / HO-(aq) O2(aq) + 4 e- + 2 H+ 2 HO-(aq)
Je peux réécrire les demi-équations en mettant à gauche les réactifs :
Fe2+(aq) / Fe(s) Fe(s) Fe2+(aq) + 2 e- x 2
O2(aq) / HO-(aq) O2(aq) + 4 e- + 2 H+ 2 HO-(aq)

THEME 1 : LES MATERIAUX CHAP.1 CYCLE DE VIE DES MATERIAUX (CHAP.7 DU LIVRE)
Ch1 –Act 2 TP Corrosion - 2/6
Je vérifie le nombre d’électrons échangés : je multiplie
2 Fe(s) + O2(aq) + 2 H+ 2 Fe2+(aq) + 2 HO-(aq) +
Sur la copie :
Fe2+(aq) / Fe(s) Fe(s) Fe2+(aq) + 2 e- x 2
O2(aq) / HO-(aq) O2(aq) + 2 e- + 2 H+ 2 HO-(aq)
2 Fe(s) + O2(aq) + 2 H+ 2 Fe2+(aq) + 2 HO-(aq)
Milieu basique : (j’ajoute autant de HO- que de H+)
2 Fe(s) + O2(aq) + 2 H+ + 2 HO- 2 Fe2+(aq) + 2 HO-(aq) + 2 HO-
2 Fe(s) + O2(aq) + 2 H2O (l) 2 Fe2+(aq) + 4 HO-(aq)
2. Les ions fer II et hydroxyde formés conduisent à la formation d’un précipité d'hydroxyde de fer (II). Ecrire l'équation
de réaction.
Fe2+(aq) + 2 HO-(aq) Fe(OH)2 (s)
3. Ce précipité d'hydroxyde de fer (II) réagit ensuite avec le dioxygène dissous pour donner un précipité d'hydroxyde
de fer (III): Données: couples rédox concernés : Fe(OH)3(s) / Fe(OH)2(s) ; O2(aq)/
(aq)
HO
(milieu basique)
Fe(OH)3(s) / Fe(OH)2(s) Fe(OH)3(s) + e- + H+ Fe(OH)2(s) + H2O x 4
O2(aq) / HO-(aq) O2(aq) + 4 e- + 2 H+ 2 HO-(aq)
4 Fe(OH)2(s) + 4 H2O + O2(aq) + 2 H+ 4 Fe(OH)3(s) + 4 H+ + 2 HO-(aq)
Milieu basique : (On ajoute autant de HO- que de H+)
4 Fe(OH)2(s) + 4 H2O + O2(aq) + 2 H+ + 2 HO- 4 Fe(OH)3(s) + 4 H+ + 2 HO-(aq) + 2 HO-
4 Fe(OH)2(s) + 6 H2O(l) + O2(aq) 4 Fe(OH)3(s) + 4 H2O(l)
On simplifie les molécules d’eau : 4 Fe(OH)2(s) + 2 H2O(l) + O2(aq) 4 Fe(OH)3(s)
4. En déduire l'équation de formation, à partir de l’hydroxyde de fer
III, de la « rouille » (produit de corrosion complexe, de composition
chimique mal définie, dont l'oxyde de fer (III) (Fe2O3) est le
constituant principal) :
2 Fe(OH)3(s) Fe2O3(s) + 3 H2O(l)
Bilan corrosion du fer :
2 Fe(s) + O2(aq) + 2 H2O (l) 2 Fe2+(aq) + 4 HO-(aq)
Fe2+(aq) + 2 HO-(aq) Fe(OH)2 (s)
4 Fe(OH)2(s) + 6 H2O(l) + O2(aq) 4 Fe(OH)3(s) + 4 H+ + 4 HO-(aq)
2 Fe(OH)3(s) Fe2O3(s) + 3 H2O

THEME 1 : LES MATERIAUX CHAP.1 CYCLE DE VIE DES MATERIAUX (CHAP.7 DU LIVRE)
Ch1 –Act 2 TP Corrosion - 3/6
5. En résumé : complétez les schémas ci-contre illustrant le phénomène de corrosion humide du fer (oxydation du fer
par le dioxygène de l’air en présence d’eau) :
La formation de rouille, terme ultime de la destruction du réseau cristallin du fer, n'est possible que si le fer est en
contact avec un milieu oxydant : une des techniques de protection consiste donc à recouvrir le fer par un
revêtement protecteur, métallique par exemple.
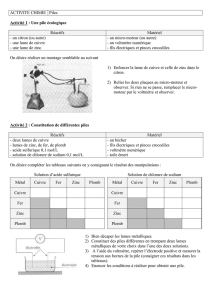
2. Cuivre ou zinc : lequel de ces deux métaux protège le mieux le fer de la corrosion humide ?
DONNEE : Pour être un bon protecteur, le métal choisi doit s’oxyder plus facilement que le fer…
A) Fer ou cuivre… Fer ou zinc… lequel s’oxyde le plus facilement ? (Compétences REA et ANA)
Rappel : le métal qui s’oxyde le plus facilement est aussi le plus réducteur. Il constitue le pôle - d’une pile constituée
de deux lames métalliques de nature différentes plongées dans une solution conductrice.
A l’aide du matériel à disposition, classer les métaux cuivre, fer et zinc du moins au plus réducteur.
Vous ferez un schéma des montages, présenterez les résultats obtenus dans un tableau et donnerez le classement final
des 3 métaux étudiés.
Matériel mis à disposition :
Bécher
Lame de Zinc
Lame de Cuivre
Lame de fer
Eau salée 1%
Voltmètre
Schémas
2 lames métalliques, l'une de
cuivre, l'autre de fer, plongées
dans de l'eau salée et reliées aux
deux bornes d'entrée d'un
voltmètre.
Le voltmètre indique 750 mV.
Interprétations :
Dans le cas : Pile Cuivre - Fer
Le voltmètre indique une valeur positive donc la borne COM du voltmètre est reliée à la borne ( - ) donc
le fer est la borne négative donc le Fer est plus réducteur que le Cuivre.
Dans le cas : Pile Zinc - Fer
Le voltmètre indique une valeur négative donc la borne COM du voltmètre est reliée à la borne ( + )
donc le fer est la borne positive donc le Zinc est plus réducteur que le Fer.
Fer
Fe2+
Fe(OH)2
Fe(OH)3
Fe2O3
V
COM
2 lames métalliques, l'une de cuivre,
l'autre de zinc, plongées dans de
l'eau salée et reliées aux deux bornes
d'entrée d'un voltmètre.
Le voltmètre indique 635 mV
2 lames métalliques, l'une de zinc,
l'autre de zinc, plongées dans de
l'eau salée et reliées aux deux
bornes d'entrée d'un voltmètre.
Le voltmètre indique – 320 mV
V
Eau salée
V
COM
V
V
COM
V

THEME 1 : LES MATERIAUX CHAP.1 CYCLE DE VIE DES MATERIAUX (CHAP.7 DU LIVRE)
Ch1 –Act 2 TP Corrosion - 4/6
Dans le cas : Pile Zinc - Cuivre
Le voltmètre indique une valeur positive donc la borne COM du
voltmètre est reliée à la borne ( - ) donc le zinc est la borne négative
donc le Zinc est plus réducteur que le Cuivre.
Conclusion :
o Le Fer est plus réducteur que le Cuivre.
o Le Zinc est plus réducteur que le Fer
o Le Zinc est plus réducteur que le Cuivre
Le Zinc est plus réducteur que le Fer qui est plus réducteur que le Cuivre
En conclusion, formulez votre hypothèse : qui, du zinc ou du cuivre, protègera mieux le fer ?…
HYPOTHESE :
Sachant que le métal qui s’oxyde le plus facilement est celui qui est le plus réducteur, le zinc étant plus
réducteur que le fer, le zinc s’oxydera plus facilement que le fer donc le zinc devrait protéger le fer.
B) Validation de l’hypothèse : influence d’un revêtement métallique sur la corrosion de clous en acier
(Compétences REA et ANA)
Dépôt de cuivre sur un clou :
Introduire un clou dans un bécher contenant une solution de sulfate
de cuivre saturée. Laisser reposer une dizaine de minutes. Sortir le
clou, le poser délicatement sur une feuille de papier absorbant.
Couple concerné : Cu(aq)
2+ / Cu(s).
Dépôt de zinc par électrolyse.
Réaliser le montage ci-dessous : L’électrolyseur sera ici un simple bécher contenant une solution de sulfate de zinc
(0,25 mol.L-1). L'anode est la lame de zinc (Couple concerné : Zn(aq)
2+ / Zn(s)) et la cathode le clou en acier.
Ajuster la tension du générateur de tension continue à 12 V et choisir le calibre de l'ampèremètre sachant que
l'intensité débitée sera voisine de 0,6 A. Faire vérifier le montage par votre professeur.
Laisser le courant circuler une dizaine de minutes. Noter la valeur de l’intensité I du courant.
Sortir le clou, le poser délicatement sur une feuille de papier absorbant.
I =

THEME 1 : LES MATERIAUX CHAP.1 CYCLE DE VIE DES MATERIAUX (CHAP.7 DU LIVRE)
Ch1 –Act 2 TP Corrosion - 5/6
Tests de corrosion
Introduire dans une boite de Pétri :
- un clou non protégé, bien décapé
- chacun des deux clous « protégés » précédemment
- un clou galvanisé.
Verser dans cette même boîte un mélange à base d'un gel agar-agar contenant de l'eau salée, de la
phénolphtaléine et de l'hexacyanoferrate II de potassium.
Attendre une dizaine de minutes et noter vos observations.
Réactif
Phénolphtaléine
Hexacyanoferrate II de potassium
Hexacyanoferrate II de potassium
Ion à
identifier
Ion hydroxyde (
(aq)
HO
)
Ion fer (II) (
2
(aq)
Fe
)
Ion zinc (
2
(aq)
nZ
)
Observation
Coloration rose
Précipité bleu
Précipité blanc
Observations dans le cadre ci-contre : on pourra s’aider de boîtes de
pétri préparées à l’avance dans les mêmes conditions expérimentales ou
de photos de ces expériences.
Interprétation : Repartir des équations de la partie 1. et utiliser le
tableau ci-dessus pour interpréter les colorations observées. Sachant que
lors d’une réaction d’oxydoréduction, l’oxydation se fait sur l’anode et la
réduction sur la cathode, penser à situer sur votre schéma la zone
anodique et la zone cathodique du clou.
Observations des résultats
Le clou en fer galvanisé ne montre aucune
coloration bleue ou rose.
On observe un voile blanc tout autour.
Le clou en fer décapé présente deux zones : une
coloration bleue et une coloration rose.
Le clou en fer recouvert de cuivre présente une
coloration rose au centre et une coloration bleue sur les
extrémités.
Le clou galvanisé (recouvert de zinc) présente un voile
blanc autour du zinc et une coloration bleue où il n’y a
pas de zinc.
Remarque : La zone colorée en bleu peut être au centre ou aux extrémités. L’usinage du clou a engendré des micro-fissures à sa
surface donc l’L’oxydation débutera à un point d’usinage qui aura un défaut donc soit au centre soit sur la tête du
clou.
 6
6
1
/
6
100%