remerciements - Accueil thèses

UNIVERSITE TOULOUSE III - PAUL SABATIER
UFR SCIENCE DE LA VIE ET DE LA TERRE
THESE
pour obtenir le grade de
DOCTEUR DE L’UNIVERSITE TOULOUSE III
Disciplines : Neurosciences et Biologie du Comportement
présentée et soutenue
par
Matthieu DACHER
le 1er septembre 2005
Titre :
ROLE DES RECEPTEURS NICOTINIQUES DANS DIFFERENTES FORMES
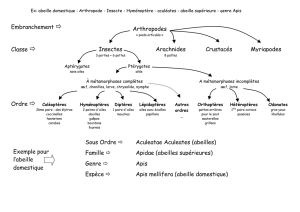
DE MEMOIRE CHEZ L’ABEILLE APIS MELLIFERA
Directrice de thèse :
Monique GAUTHIER
JURY
M. Martin GIURFA, professeur à l’Université Toulouse III Président
M. Bernard FRANCES, professeur à l’Université Toulouse III Examinateur
M. Thomas PREAT, directeur de recherches à Gif-sur-Yvette Examinateur
M. Raymond CHICHERY, professeur à l’Université de Caen Rapporteur
M. Yves LE CONTE, directeur de recherches à Avignon Rapporteur
Mme Monique GAUTHIER, professeur à l’Université Toulouse III Directrice

2

REMERCIEMENTS
Il est un bon usage, en thésiennes rédactions :
Celui de rendre grâce, en tête de l’escrit,
Aux nobles gentilhommes, aux dames pleines d’attentions,
A ceux quy par leurs actes, m’amènent à dire mercy.
Icelles actions de grâce, iceux remerciements,
Ne sont point convenances, encore moins boniments,
Mais vray reconnaissance, et justes compliments.
Les voicy quy commencent, par maistres du jugement.
A vous aussy, ô apidologiques confrères,
Je souhaiterai présenter un hommage appuyé :
Tous unis, tous ensembles, portant la même bannière,
Rassemblés d’un seul cœur, d’Abeilles les écuyers.
Cognition animale, voicy noble sujet !
Vous belles damoiselles, vous gentils chevaliers,
Dont l’esprit de la beste des recherches est l’objet,
Je vous fais mes adieux, nous quy étions alliés.
Après toute cette parlure, encrant tout ce papier,
Il me faut tous mes proches, remercier également,
Par alliance contractée, ou bien par lien du sang,
Ou bien même amitié aux fidèles équipiers.
C’est en exprimant ma gratitude à Martin Giurfa que je commencerai ces remerciements.
Je suis heureux et honoré qu’il soit président de mon jury de thèse, et je le remercie également
pour le travail qu’il accomplit en tant que directeur de notre laboratoire.
Je remercie également Raymond Chichery, que j’avais rencontré avant même le début de
mon DEA et que j’ai recroisé plusieurs fois par la suite, ce qui m’a conduit à faire appel à lui pour
évaluer mon manuscrit. A cette occasion, j’ai une nouvelle fois constaté votre sérieux scrupuleux
et bienveillant. Je souhaite également remercier Yves Le Conte, le second rapporteur de ma thèse,
dont j’ai pu apprécier les commentaires pertinents, signes d’une lecture méticuleuse. J’associe à
ces remerciements Thomas Préat et Bernard Francés, qui ont bien voulu juger ce travail.
Remerciements 3

Il est essentiel dans ces remerciements de mettre en valeur le rôle de Monique Gauthier,
ma directrice de thèse. Notre travail commun a été fructueux, de l’écriture du premier article
jusqu’à la rédaction de la thèse (et en particulier de l’introduction), et je ne saurais lui exprimer
suffisamment ma reconnaissance pour ce que j’ai pu devenir grâce à elle.
Je souhaite remercier le groupe abeille dans son ensemble pour son amitié et son support :
Sandrine Paute pour son aide technique, Valérie Raymond-Delpech pour les nombreux apports
théoriques fait à mon travail, Cathy Armengaud pour nos travaux en commun, Michel Lambin
pour sa sagesse bienveillante et son aide pour la réalisation des photos de ce travail, Maria-
Gabriela de Brito-Sanchez pour la gaité introduite dans notre bureau, Steeve Thany notre
courageux moléculariste, Vincent Garry le dernier rempart des abeilles face au fipronil, le
vaillant pompier algérien Hicham Kacimi (nouvelle preuve de l’œcuménisme de notre équipe) et
Tristan Jaillard son pyromane collègue. De nombreux stagiaires ont eu l’occasion de travailler
avec moi : Aurélie, Jean-Baptiste, Amélie, Maude et Pierre, merci d’avoir accepté pour
quelques semaines de subir à mes côtés les dommages collatéraux de ma thèse. Bonne
continuation dans vos études respectives.
Avec beaucoup de chaleur, je souhaite remercier tout particulièrement Patrice Déglise et
Guillaume Barbara, ainsi bien sûr que Delphine et Sabrina. Outre le soutien mutuel que nous
nous sommes portés, je veux aussi rendre hommage à vos qualités scientifiques et humaines et à
votre amitié que j’ai pu apprécier tout au long de ces années.
Je poursuis mes remerciements avec le reste du groupe abeille ; merci donc à Jean-Marc
Devaud, Jean-Christophe Sandoz, Nina Deisig, Edith Roussel et Isabelle Massou. A Marco
Schubert, Fernando « Mordi » Guerrieri, Fabienne Dupuy, Vanina Vergoz, Julie Bénard et
Yukihisha Matsumoto, je souhaite bon courage et bonne continuation, avec des remerciements
spéciaux pour tous les souvenirs ramenés du colloque de Nyborg. De façon un peu plus formelle,
je remercie également Yuki pour m’avoir fourni le L-NAME et le D-NAME que j’ai utilisé dans
ce travail.
Enfin, je n’oublie pas parmi mes collègues tous ceux qui travaillent sur des
« honigbienen » plutôt que sur l’abeille. Je remercie donc Joachim Erber pour m’avoir accueilli
dans son laboratoire durant six semaines et Ricarda Scheiner pour ses conseils sur les
expériences de sensibilité au sucre. Il me faut aussi remercier Bernd Grünewald pour sa
collaboration avec notre équipe. Enfin, Stephan Shuishi Haupt, je ne sais comment te remercier
pour ton soutien sans faille durant mon séjour berlinois, et aussi pour les informations partagées
sur l’habituation.
Remerciements 4

Jean-Michel Lassalle, mérite un triple remerciement, en tant que responsable du
DEA « Neuroscience, Comportement, Cognition » grâce auquel mes travaux ont
commencé, de l’antenne de l’école doctorale CLESCO et de la commission des thèses qui
a validé ce travail. Je veux donner un remerciement particulier et très chaleureux à
Christian Jost. Dans pratiquement tous les modules où je suis intervenu lors de mes
cours, tu étais à mes côtés pour me conseiller et m’encadrer. Tu es avec Monique et dans
le domaine de l’enseignement l’un des principaux formateurs de mes années de thèse.
Je remercie également Pascal Roullet pour les conversations que nous avons eues
et qui m’ont éclairé sur certains points concernant la mémoire, et David Macquart et
Sébastien Daly-Schweitzer pour les pauses salutaires que nous avons partagées
ensembles. Il serait un peu fastidieux d’énumérer tous les membres passés et présents
du Centre de Recherches sur la Cognition Animale. C’est donc collectivement que je
vous remercie pour toutes ces années passées ensembles. Vous me manquerez.
Khalid Lamine, merci pour ta sollicitude et ta gentillesse. Jacques Lauga m’a
beaucoup appris sur le monde des statistiques. Je ne peux donc que le remercier pour le
patrimoine qu’il m’a laissé.
Didier Jourdan, Stéphane Boghossian et Josette Alliot méritent des
remerciements particulièrement chaleureux. C’est en effet à vos côtés il y a six ans déjà
que j’ai commencé mon métier de chercheur. Si j’arrive au terme de mes études
aujourd’hui (mais y arrive t-on jamais ?), c’est à cause de la solidité et de la rigueur des
bases que j’ai découvertes grâce à vous.
Mes chers parents, cette thèse est un peu votre petite fille ; du début à la fin vous
en avez suivi la gestation avec opiniâtreté en prodiguant toujours aides et encouragements
lorsqu’il le fallait. Je vous suis reconnaissant, et ma piété filiale est à la mesure de tout ce
que vous avez fait pour moi depuis le commencement.
Pour avoir été avec constance et affection à mes côtés pendant tout ce temps, merci
également à toute ma famille. Toutes nos réunions sont autant d’excellents souvenirs
pour tenir dans les moments difficiles, et votre affection, votre soutien et votre curiosité
pour mes étranges occupations sont de formidables appuis pour moi.
A vous tous, ex-membres de ma promotion de DEA, mille mercis … Bien que j’ai
une pensée pour chacun de vous, je souhaite adresser en particulier mes remerciements à
Adeline pour notre complicité téléphonique.
Remerciements 5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
 196
196
 197
197
 198
198
 199
199
 200
200
 201
201
 202
202
 203
203
 204
204
1
/
204
100%