les modeles atomiques

Fiche 20
LES MODELES ATOMIQUES
A. La modélisation :
Comme il est impossible de photographier un atome ou une molécule, il faut représenter la
réalité par un modèle plus ou moins précis.
Le but du modèle, c'est expliquer aussi simplement que possible un phénomène très
complexe :
Le choix du modèle dépendra de ce que l'on veut montrer. Si l'on veut étudier la structure
cristalline des solides, de simples balles de ping-pong suffisent pour modéliser les atomes.
On prend donc une forme géométrique simple, la sphère. Le seul paramètre à donner
pour caractériser un atome est son rayon (ou son diamètre).
Exemple : une modélisation du sel de cuisine NaCl.
Par contre, si l'on veut expliquer le comportement chimique de tel ou tel atome, il faudra
connaître comment sont agencés les électrons à l'intérieur de l'atome.
Exemple : une modélisation de l'oxygène, selon Kimball.

Fiche 20 Les modèles atomiques
- 2 -
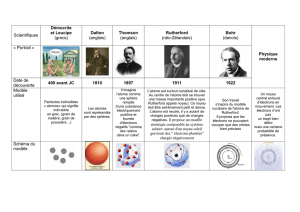
B. Les principaux modèles atomiques :
1798 DALTON
Sphère compacte. Tous les atomes d'un même élément sont
identiques ; chaque élément possède sa propre sorte d'atome.
1897 THOMPSON
Il découvre que l'atome contient des particules plus petites, chargées
négativement. Ces particules ont été appelées électrons. Dans le
modèle de Thompson, les électrons n'ont pas de position ni de
trajectoire définies : ils baignent dans une "soupe" chargée
positivement.
1911 RUTHERFORD
L'atome est constitué d'un noyau central très petit (un dix-millième du
diamètre atomique) qui comprend la quasi-totalité de la masse de
l'atome. Ce noyau, porteur d'une charge électrique positive, est
entouré d'une enveloppe négative formée d'électrons.
1913 BOHR
Les électrons négatifs formant l'enveloppe sont répartis en couches
concentriques plus ou moins éloignées du noyau positif.
Une représentation en 2-D plus simple est utilisée pour expliquer le
remplissage des couches électroniques.
A droite, la représentation de l'atome de potassium en modèle de Bohr.
1913 LEWIS
Lewis proposa l'hypothèse suivante : les électrons de la couche
externe sont responsables des liaisons entre atomes, la liaison étant
assurée par des paires d'électrons résultant de la mise en commun
d'électrons appartenant aux atomes liés.
Graphiquement, on ne dessine que les électrons de la dernière
couche.
A droite, la représentation de l'atome d’oxygène en modèle de Lewis.
K

Fiche 20 Les modèles atomiques
- 3 -
1959 KIMBALL
L'atome est constitué d'un cœur positif comprenant le noyau
atomique et les couches électroniques internes.
Autour du cœur, on trouve des lieux géométriques contenant
1 ou 2 électrons. Ces lieux sont appelés des orbitales. Les
orbitales étant des zones de l'espace chargées négativement,
elles se repoussent le plus possible.
Le modèle de Kimball peut être considéré comme une
représentation spatiale de celui de Lewis.
A droite, la représentation de l'atome de fluor en modèle de
Kimball.
C. Les principaux modèles moléculaires :
Quatre différents modèles moléculaires sont représentés ci-dessous pour la même
molécule, l'éthanol (C2H6O).
LE MODELE DE LEWIS :
H C
H
H
C
H
H
O H
LE MODELE TOPOLOGIQUE
(OU ZIG-ZAG) :
O
H
LE MODELE BOULES ET TIGES :
LE MODELE COMPACT :
1
/
3
100%