Sciences de la Vie et de la Terre

Sciences de la Vie et de la Terre
En collaboration avec
Olivier Avisseau,
Professeur de SVT
Académie de Versailles
www.jeulin.fr | 0 825 563 563*
*0,15€ TTC l'appel à partir d’un poste fixe du lundi au vendredi de 8h30 à 17h30.
Protocoles
de Travaux Pratiques
POUR LE LYCÉE

• 2
FAVORISONS
LE SAVOIR-FAIRE
FRANÇAIS
Jeulin s’engage pour vous
Pour favoriser le
tissu industriel français
Pour préserver
l’emploi en France
Pour une consommation
responsable
Pour le respect
des normes
*0,15€ TTC/min. à partir d’un poste fixe du lundi au vendredi de 8h30 à 17h30.
0 825 563 563*
Contactez-nous
• Nos conseillères vous guideront dans votre choix
• Votre conseiller commercial est à votre disposition.
www.jeulin.fr
pour en savoir plus

3 •
TP
Sciences de la Vie et de la Terre
Sommaire général
TP Le spectre d'absorption
d'une solution de pigments foliaires 4
TP Cyanobactéries
et formation des stromatolithes 6
TP Acquisition de la bipédie et appartenance
au genre Homo 8
TP Exploitation de l'Imagerie Didactique On Line :
Mise en activité de l'ovaire
à partir de la puberté 10
TP Les roches constitutives
de la croûte terrestre 12
TP Le ver plat de Rosco,
une illustration de la biodiversité 14
TP La réaction de Hill 16
TP Mutation et développement oral
chez
Arabidopsis thaliana
18
TP Mise en évidence de la variation allélique
du gène de l'amélogénine par la PCR 20
TP Electrophorèse comparative de lapin
immunisé et non immunisé 22
TP Inuence de l'irradiation aux UV
sur une culture de levures 24
TP Les diérentes protections contre les UV 26
TP SVT

• 4
Extrait B.O.
Vigne vierge. Épine vivette pourpre.
Filtration et dilution d'une solution de pigments de feuilles de vigne vierge.
Dilution d'une solution de pigments de feuilles d'épine vivette.
TP Le spectre d'absorption d'une solution de pigments foliaires
Nombre de séances : 1
Niveau de difficulté :
Mode opératoire
Terminale S - Spécialité :
Énergie et cellule vivante
(thème 1).
Problématique scientifique
La photosynthèse permet
aux végétaux chlorophyl-
liens de fabriquer des mo-
lécules organiques à partir
de molécules minérales
(ex : dioxyde de carbone).
Cela n'a lieu que dans les
parties chlorophylliennes
de ces végétaux et néces-
site des radiations de la
lumière visible. Comment
les parties chlorophyl-
liennes interagissent-elles
avec ces radiations lumi-
neuses ? D'autre part, cer-
tains végétaux possèdent
des feuilles dont la couleur
peut être rouge et non
verte. Sensibles pourtant
à l'absence ou la présence
de lumière (sénescence ou
développement), comment
les pigments de ces feuilles
interagissent-ils avec les
radiations de la lumière
visible ?
Les acquis de la classe de Seconde relatifs à la
photosynthèse (Thème 2) permettent de poser
les problèmes à résoudre et initier une démarche
d'investigation. De plus, on s'assurera de quelques
acquis de Physique (lumière, décomposition,
spectre, etc.). Dans ce cadre, on attend que les
parties chlorophylliennes aient la capacité d'absor-
ber les (ou des) radiations de la lumière visible.
On procède alors à une extraction (solubilisation)
des pigments foliaires an d'établir le spectre
d'absorption de la solution obtenue. La comparai-
son du résultat obtenu avec des feuilles vertes et
rouges permet de révéler l'absorption de radiations
communes. Pour cette activité, il est tout à fait
possible (voire souhaitable) de travailler sur des
végétaux communs que les élèves peuvent rencon-
trer (jardins, cour de l'établissement, parcs, etc.).
Avant le TP
Dans un mortier, disposer quelques feuilles
découpées à l'aide de ciseaux, additionnées d'un
petit volume d'éthanol absolu (solvant) et d'un
peu de sable. Broyer ensuite les feuilles sans créer
d'émulsion jusqu'à ce que l'éthanol soit chargé de
pigments (il prend la couleur initiale des feuilles).
Filtrer la solution obtenue ; celle-ci étant proba-
blement trop concentrée, il faut la diluer avec le
solvant employé. La solution est ensuite versée dans
une cuve à spectrophotomètre.
➞
Trucs et astuces
Cette activité est réalisable
toute l'année sur de nombreux
végétaux dans la mesure où
leurs feuilles se conservent très
bien au congélateur (-18 °C)
sans que les pigments foliaires
soient altérés.
Attention : l'extraction des
pigments foliaires ne doit pas
se faire à l'aide d'acétone,
dont la présence rendrait alors
immédiatement opaque le
plastique des cuves. Utiliser
sinon des cuves en verre.
➞

5 •
Spectrophomètre à fibre optique.
Matériel nécessaire
TP Le spectre d'absorption d'une solution de pigments foliaires
Pendant le TP
Il s'agit de réaliser le spectre d'absorption
des solutions diluées obtenues. Les mesures
sont effectuées à l'aide du spectromètre
à bre optique. Aucune installation n'est
requise pour l'utilisation de l'appareil.
Connecter l'appareil à un ordinateur via un
câble USB. Une fois le spectromètre détecté,
l'application « Atelier Scientique » qui se
trouve dans l'appareil se lance. Choisir la
mesure d'absorbance en cliquant sur l'onglet
latéral correspondant. En un premier temps,
il faut calibrer l'appareil en faisant le « zéro »
d'absorbance (remplir une cuve du solvant
ayant servi à l'extraction des pigments
foliaires) puis le « 100 % » d'absorbance
(placer le cache noir dans le porte-ltre). Le
mode opératoire pour calibrer le spectro-
mètre est indiqué à l'écran : il suft de suivre
les étapes indiquées par le logiciel.
Une fois l'appareil calibré, placer la cuve
contenant une solution diluée de pigments
foliaires dans le porte-cuve. Nommer la solu-
tion via le logiciel et choisir la couleur de la
courbe avant de lancer la mesure (ces élé-
ments pourront être modiés par la suite
si on le souhaite). L'afchage du résultat
apparaît immédiatement après avoir lancé
la mesure. Si la courbe présente des « crêtes »
(paliers d'absorption), il faut procéder à
nouveau à la dilution de la solution.
Spectrophotomètre SOFI2 Réf. 202 896
Éthanol dénaturé 95° Réf. 102 002
Papier ltre Réf. 703 076
Sable grain moyen Réf. 704 029
Entonnoir 100 mL forme
conique en verre standard Réf. 713 026
Erlenmeyer 250 mL à
ouverture étroite en Pyrex®Réf. 713 602
Mortier avec pilon 300 mL
en porcelaine émaillée Réf. 723 130
Pour aller plus loin
L'obtention et la dilution d'une solution de
pigments ne présentant aucune difculté
technique, l'utilisation du spectrophotomètre
étant très simple, il est alors possible de réa-
liser la manipulation avec une jolie diversité
de feuilles. La modication de l'équipement
pigmentaire à la saison automnale est
l'occasion d'aborder aussi le recyclage des
chlorophylles au sein de la feuille (même si
cela n'est pas exigible dans le programme de
Terminale Spécialité SVT, il peut donner lieu
à un sujet de TPE par exemple).
On peut aussi coupler l'étude du spectre
d'absorption avec la réalisation d'une chro-
matographie des pigments foliaires qui
conrmera la présence de chlorophylles dans
les feuilles d'Épine vivette pourpre.
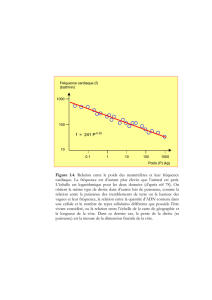
Comparaison des spectres d'absorption des pigments
foliaires de la vigne vierge (courbe bleue) et de l'Épine
vivette pourpre (courbe rouge).
Spectre d'absorption des pigments foliaires
de la vigne vierge.
Résultats et exploitations
Les pigments foliaires de la vigne vierge
ont deux pics d'absorption, le premier vers
430 nm (radiations bleues) et le second vers
660 nm (radiations rouges). Ces pics sont à
rapprocher des pigments contenus dans les
feuilles : il s'agit des chlorophylles.
Les pigments foliaires de l'épine vivette
pourpre ont aussi un pic d'absorption à
660 nm. Malgré la couleur des feuilles de
ce végétal, le spectre d'absorption révèle la
présence de chlorophylle.
En résumé
Les pigments foliaires absorbent préféren-
tiellement certaines radiations de la lumière
visible, ce qui constitue un apport d'énergie
initial indispensable au déroulement de la
photosynthèse. Les radiations lumineuses
absorbées le sont par des pigments foliaires,
dont les chlorophylles. La comparaison du
spectre d'absorption de végétaux, en appa-
rence différents, révèle la présence de pig-
ments communs comme les chlorophylles.
TP SVT
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
1
/
28
100%