La première semaine de développement : la segmentation

Embryologie Chapitre 4 : la première semaine de développement
1
La première semaine de développement : la segmentation
La segmentation a lieu au cours de la migration tubaire, c'est-à-dire du transit du cellule-œuf depuis
l'ampoule tubaire, siège de la fécondation, jusqu'à la cavité utérine, où s'effectuera la nidation.
Cette période, dite pré-implantatoire, correspond exactement à la 1ère semaine du développement.
I ) La segmentation
Elle consiste en une série de divisions morcelant l'œuf en cellules de plus en plus petites appelées
blastomères, ce qui aboutit à la formation d'un blastocyste, dans lequel les cellules à l’origine du
futur placenta se distinguent déjà des cellules embryonnaires.
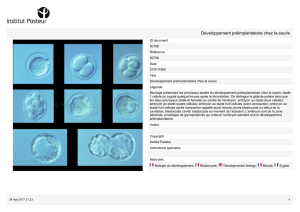
1 ) Formation de la morula
Les premières divisions donnent des blastomères (d'abord 2, puis 4, etc.) de forme sphérique et de
taille identique, dont la surface, comme celle de l'œuf, est hérissée de microvillosités. A partir d’une
douzaine de blastomères la cellule-œuf prend la forme d'une petite mûre, appelée morula, dans
Les étapes de la segmentation

Embryologie Chapitre 4 : la première semaine de développement
2
laquelle les cellules sont seulement juxtaposées, indépendantes les unes des autres (la rupture de la
zone pellucide les disperserait). Sa taille est identique à celle de l'œuf (110 µm environ).
2 ) Compaction de la morula
Lorsqu'il y a une vingtaine de blastomères, ceux-ci deviennent solidaires et leur forme sphérique
disparait.
Cette compaction met en jeu des protéines membranaires impliquées dans les modifications de la
forme cellulaire et dans l'adhérence intercellulaire : ce sont les protéines de la famille des CAM (Cell
Adhesion Molecules) : l'ankirine, la vinculine, la foldine, la connexine et surtout une E-cadhérine
appelée uvomoruline.
D'abord réparties uniformément ces molécules se regroupent aux points de contact intercellulaire. Le
rôle de l'uvomoruline est capital pour l'initiation de la compaction (l'administration d'anticorps
dirigés contre cette cadhérine ou l'inactivation du gène la codant empêche la compaction), tandis que
la connexine 43 intervient dans son maintien (l'invalidation du gène la codant provoque la
désagrégation de la morula). La compaction ne peut se faire qu'en présence de Ca++ (dans un milieu
sans Ca++ il y a dispersion des blastomères), et ces molécules se lient par leurs radicaux glucidiques
externes (l'administration de tunicamycine, inhibitrice de la glycosylation, empêche la compaction).
Se constituent ainsi des liaisons intercellulaires spécialisées : jonctions communicantes (gap
junctions), jonctions serrées (tight junctions), desmosomes, qui relient entre eux les blastomères.
Au cours de cette compaction il apparaît deux types de blastomères, déterminés par leur position : les
périphériques deviennent plus petits (micromères) et subissent une polarisation (gradient de
disposition des organites) de plus en plus nette, alors que les centraux sont plus volumineux
(macromères) et moins polarisés.
3 ) Cavitation de la morula : apparition du blastocyste
Dès que la morula a une trentaine de blastomères, il apparaît des
lacunes intercellulaires, qui fusionnent ensuite en une cavité
unique de plus en plus volumineuse. Le contenu de cette cavité
provient de l'extérieur, grâce à l'activité Na-K ATPase dont sont
dotés les micromères et qui entraîne un courant d'ions Na+ et donc
un flux liquidien, par action osmotique, vers cette cavité. La
cellule-œuf devient alors un blastocyste (ou blastula), avec une couche périphérique de cellules
aplaties formant le trophoblaste ou trophectoderme, la cavité blastocystique ou blastocèle, et un
groupe de cellules sphériques appendu au trophoblaste, formant l'embryoblaste ou bouton
embryonnaire (encore appelé masse cellulaire interne).
4 ) Eclosion du blastocyste
A la fin de la segmentation le blastocyste subit
une expansion de sa cavité qui amène son
diamètre à 200 µm. La zone pellucide distendue

Embryologie Chapitre 4 : la première semaine de développement
3
se rompt alors sous l'influence d’une protéase, la strypsine, sécrétée par le trophoblaste. Il apparaît un
orifice par lequel le blastocyste sort en se déformant. Cette phase est indispensable, car la persistance
de la zone pellucide empêcherait la prise de contact entre le blastocyste et la muqueuse utérine lors
de la nidation.
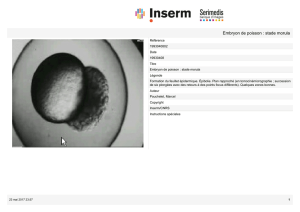
II ) Caractéristiques de la période pré-implantatoire
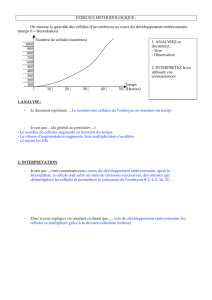
1 ) Chronologie de la segmentation
Le temps 0 étant le contact intergamétique :
- stade à 2 blastomères, à la 24ème heure,
- stade à 4 blastomères, à la 48ème heure,
- stade à blastomères, à la 70ème heure,
- stade morula (15 à 50 blastomères), les 4ème et 5ème jours,
- stade blastocyste, les 6ème et 7ème jours, avec l’éclosion le 7ème jour.
2 ) Activité mitotique
Le rythme des premières divisions est d'une vingtaine d'heures puis il se raccourcit pour passer à une
quinzaine d'heures. Elles sont théoriquement synchrones au début de la segmentation, mais il n’est
pas rare d’observer des stades fugaces à 3, 5, 6 ou 7 cellules.
A partir du stade morula avancé il n'y a plus de synchronisme, les micromères et les cellules
trophoblastiques qui en dérivent se divisant plus vite que les macromères et les cellules de
l'embryoblaste. L’apoptose touche aussi certaines cellules et ce d’autant plus que la segmentation
avance. Au 7ème jour le blastocyste comprend environ 200 cellules, dont une quarantaine seulement
pour le bouton embryonnaire.
Les premiers cycles cellulaires de la segmentation diffèrent de ceux des cellules somatiques
ultérieures, ils sont biphasiques, avec seulement une phase S et une phase M. Ils sont régulés par une
protéine ubiquitaire, le MPF (Mitosis Promoting Factor), active pendant la phase M et inactive
pendant la phase S. Ce MPF comporte 2 sous-unités. La plus petite est une protéine kinase (kinase
cdc2) qui a comme cible l'histone Hl (intervenant dans la condensation des chromosomes), les
laminines de l'enveloppe nucléaire (rupture de cette enveloppe) et la myosine cytoplasmique
(ATPase engagée dans le fonctionnement des filaments d'actine du cytosquelette). La plus grosse
sous-unité est une cycline, dont la concentration oscille périodiquement : elle s'accumule pendant la
phase S et est dégradée pendant la phase M ; c'est elle qui rend active la petite sous-unité.
3 ) Les synthèses protéiques
Tout au long de la segmentation les blastomères synthétisent des protéines, celles qui sont
indispensables à l'activité mitotique (cycline, tubuline, ADN polymérase, etc.) ou au déroulement des
différentes phases de la segmentation (uvomoruline, strypsine, etc.).

Embryologie Chapitre 4 : la première semaine de développement
4
Quantitativement ces synthèses sont faibles, car le volume cellulaire total n'augmente pas : si le
diamètre du blastocyste est deux fois plus élevé que celui du zygote c'est à cause de la formation de
la cavité blastocystique.
Au début de la segmentation ces synthèses protéiques résultent uniquement de la traduction des
ARN d’origine maternelle stockés par l’ovocyte durant sa maturation. La preuve en est qu'à ce
stade l'administration d'inhibiteurs de la transcription, comme l'α-ammanitine, n'empêche pas ces
synthèses. C'est seulement à partir du stade 4-8 blastomères appelé MZT (Maternal to Zygote
Transition), que le génome embryonnaire diploïde commence à fonctionner et à synthétiser ses
propres ARN.
Le degré de maturation ovocytaire est donc déterminant pour la viabilité embryonnaire : si les ARN
maternels sont insuffisants, le relais est rompu entre leur utilisation et le démarrage du génome
embryonnaire, et il y aura blocage précoce du développement.
4 ) Autonomie de la cellule-œuf
La cellule-œuf n’est pas autonome malgré l’absence de contact avec l’organisme maternel pendant
la migration tubaire. En effet l’organisme maternel produit des métabolites indispensables à
l'embryon et aussi des hormones comme l'insuline, qui a un effet mitogène, des facteurs de
croissance comme EGF (Epidermal Growth Factor) et TGF (Transforming Growth Factor) qui ont
des effets mitogènes et morphogénétiques, PDGF (Platelet Derived Growth Factor) qui a des effets
sur le blastocyste par l'intermédiaire de la protéine c-myc elle-même codée par l'embryon.
A l'inverse l’embryon sécrète des substances (des peptides) qui sont reçues par les muqueuses tubaire
et utérine; il a été montré dans certaines espèces que ces signaux embryonnaires (kentsine, PAF ou
Platelet Activating Factor) peuvent modifier la motricité tubaire ou même les sécrétions ovariennes.
Il y aurait donc tout au long de cette période pré-implantatoire un échange d'informations
réciproques, entre organisme maternel et embryon, dont la finalité est, sinon d'améliorer, tout au
moins de préserver la viabilité embryonnaire.
5 ) Distinction trophoblaste – embryoblaste
Il s’agit là du premier événement d’orientation ou d'engagement cellulaire. Les deux groupes de
cellules commencent à se distinguer avec leurs précurseurs, micromères et macromères, qui prennent
leur orientation définitive en fonction de leur disposition spatiale.
Au stade blastocyste, elles diffèrent par leur activité de synthèse, leur rythme mitotique et leurs
caractères morphologiques ultrastructuraux. Les cellules du trophoblaste ressemblent à des cellules
épithéliales, avec des jonctions intercellulaires adhérentes (desmosomes, avec la plakoglobine), un
réseau spécifique de microfilaments (cytokératine) et une polarité (disposition des organites,
microvillosités du côté externe). Les cellules du bouton embryonnaire ne possèdent pas cette polarité
et sont caractérisées par la présence de nombreux ribosomes et de jonctions communicantes (gap
jonctions).
La destinée de ces cellules est désormais fixée: celles du bouton embryonnaire fourniront
l'embryon et celles du trophoblaste le placenta. Le bouton embryonnaire va fournir aussi les
annexes de l'embryon.

Embryologie Chapitre 4 : la première semaine de développement
5
6 ) Totipotences des blastomères
Les premiers blastomères sont totipotents, comme le zygote ; autrement dit, chacun d'eux peut,
s'il est isolé, produire un embryon harmonieux avec son placenta puis un enfant normal. Cette
totipotence s’amenuise progressivement car à partir du stade morula compactée, il faut un groupe de
cellules, macromères et micromères, et non une seule pour obtenir le même résultat.
Au stade blastocyste seules les cellules du bouton embryonnaire ont conservé cette propriété, mais
elles ne fourniront pas de placenta et comme précédemment il faut un groupe de cellules et non une
seule pour obtenir un embryon harmonieux. Cette propriété appelée régulation, persistera encore
lors des premiers jours de la 2ème semaine, dans le disque embryonnaire, dérivé du bouton
embryonnaire. Sa scission spontanée aboutit à la naissance de jumeaux vrais ou monozygotes,
véritables clones naturels.
A côté de cette régulation des déficiences, il peut aussi y avoir une régulation des excès: la fusion de
deux embryons, c’est-à-dire la mise en commun de leurs cellules, jusqu'au stade morula, peut se
produire spontanément et conduire à la formation d'un seul embryon harmonieux qui est une
chimère composée de clones cellulaires juxtaposés et mélangés possédant deux patrimoines
génétiques distincts, parfois de sexe génétique différent (hermaphrodites vrais).
Expérimentalement la séparation des blastomères pour fournir des clones a été réalisée chez certaines
espèces de mammifères ainsi que la production de chimères soit par fusion de deux morulas, soit par
injection dans la cavité blastocystique de cellules du bouton embryonnaire provenant d'un autre
embryon, qui vont s'agglomérer avec celles du premier. Les cellules du bouton embryonnaire isolées
ne sont plus totipotentes mais multipotentes : elles peuvent produire in vitro toutes sortes de types
tissulaires en fonction des conditions de culture. Elles sont de ce fait appelées cellules souches
embryonnaires ou cellules ES.
7 ) L’extinction génomique partielle
L'empreinte parentale
La présence de 2n ADN est indispensable au développement de l'embryon, mais cela n'est pas
suffisant, il faut que ces 2n ADN soient complémentaires.
Si expérimentalement on remplace le pronoyau mâle par un pronoyau femelle venant d'un autre œuf
on obtient un gynogénote, à 2n ADN d’origine maternelle, qui produira un embryon presque normal
et un déficit d’ébauches placentaires empêchant le développement de l’embryon.
A l'inverse, si on remplace le pronoyau femelle par un pronoyau mâle on aura un androgénote à 2n
ADN paternels, à l’origine d'un embryon minime quasi-inexistant mais avec un excès de tissu
placentaire.
Les 2 lots d’ADN parentaux exercent donc dès ces stades des fonctions complémentaires, qui
proviennent de l'empreinte génétique reçue pendant la gamétogenèse.
La lyonisation
C'est pendant la segmentation que se produit dans les embryons de sexe féminin l'inactivation d'un
des chromosomes X.
 6
6
1
/
6
100%