UE immunologie – 26-03-13 – Dr Carole Guignant Immunologie de

UE immunologie – 26-03-13 – Dr Carole Guignant
Immunologie de la grossesse
Objectifs : comprendre les mécanismes mis en place permettant le non-rejet immunologique du fœtus par la
mère.
Rappel : « soi », « non soi » et HLA
Un des rôles majeurs du SI est de défendre les cellules du soi (propre à un organisme donné) contre les
éléments du « non-soi » : micro-organismes étrangers (virus, bactérie), cellules étrangères (d’un autre
organisme) et cellules devenues étrangères (cancer).
Repose sur la capacité à reconnaître le soi du non soi par la présence de différents marqueurs protéiques à la
surface des cellules :
- groupes sanguins (dont ABO) au niveau des globules rouges
- molécules du CMH
Les molécules du CMH :
De classe I :
dites « classiques » : HLA-A, HLA-B, HLA-C
exprimées à la surface de quasiment toutes les
cellules, très polymorphes : très grand nombre de
variants (ou allèles)
Combinaisons possibles quasi-infinies
Chaque individu a un jeu particulier de molécules HLA
dites « non classiques » : HLA-E, HLA-F, HLA-G :
expression tissulaire beaucoup plus restreinte et
de faible polymorphisme.
De classe II :
- Exprimée surtout sur les cellules présentatrices
d’Ag
- HLA-DP, HLA-DQ, HLA-DR
Combinaison molécules HLA + protéines = molécules du soi
Un individu rejettera toute greffe de cellules ou d’organes en provenance d’un autre organisme avec une
combinaison différente de molécules HLA
Principales cellules effectrices du rejet de greffe :
- LTCD8+ cytotoxiques via molécules CMH I
- LTCD4+ auxiliaires via molécules CMH II
- Cellules dendritiques
- Cellules NK
Le fœtus exprime à la fois des protéine et des molécules HLA propres au père (50%) et à la mère (50%) = semi
allogreffe
Rappel :
Allogreffe : entre individus différents d’une même espèce
Autogreffe : même individu
Xénogreffe : entre espèces différentes
Pourquoi le fœtus n’est pas rejeté par la mère ?
Hypothèses du Pr Peter Medwar (rejet de greffe 1960)
- fœtus isolé du SI de la mère par le placenta ?
- Ag fœtaux immatures et non reconnus par le SI de la mère ?
- Système immunitaire de la mère non réactif vis-à-vis des antigènes fœtaux ?
- Mise en place d’une tolérance materno-fœtale active ?
A. fœtus isolé du SI de la mère ?
Site d’implantation du fœtus (endomètre) riche en leucocytes maternels :
- 70% LNK
- 10% LT
- 20% Monocytes
Le fœtus est protégé dans le liquide amniotique, pas de contact direct entre sang maternel et sang fœtal mais 2
interfaces foeto-maternelles importantes :
- syncytiotrophoblaste (SYN) et cellules immunitaires maternelles circulantes
- trophoblastes extravillleux (EVT) et cellules immunitaires circulantes et de la déciduale

Passage des IgG maternelles à travers le placenta
Effet protecteur pour le fœtus : vis a vis des différents pathogènes déjà rencontrés par la mère immunité
passive à « court terme ».
Effet néfaste pour le fœtus : maladie auto-immune :
o Lupus et anti corps anti-SSA
Expression cutanée chez le fœtus qui persiste après la naissance tant qu’il présente les Ig de la mère puis
disparaît après l’élimination de ces Ig. Les Ac anti SSA peuvent aussi induire un BAV en se dirigeant contre le
myocarde du fœtus.
o Anémie hémolytique du nourrisson
Acs maternels anti-rhésus. Lors de la première grossesse la femme enceinte s’immunise contre le Rh+ de
l’enfant 1, lors d’une seconde grossesse, si l’enfant 2 est aussi rhésus + les Ig acquises par la mère lors de la
première grossesse se dirigent contre les GR de l’enfant. Il faut injecter après l’accouchement des Ig anti-
Rhésus (neutralisent les GR du fœtus présents dans la circulation maternelle)
Des cellules fœtales détectées dans le sang de la mère pendant la grossesse et même après, des cellules de la
mère détectée chez ses enfants après la délivrance.
Le trophoblaste n’est donc pas une barrière physique impénétrable qui empêche totalement le passage des
cellules de la mère ou du fœtus.
Le trophoblaste relargue des micro-particules dans la circulation sanguine maternelle.
Ex : débris cellulaires résultants du processus de renouvellement de la surface placentaire Ag paternels
présents phagocytose par CPA maternelles présentation au SI adaptatif de la mère.
B. Ag fœtaux non reconnus par le SI maternel ?
C. Pas de réaction maternelle possible contre Ag fœtaux ?
Cellules immunitaires de la mère peuvent répondre contre Ag fœtaux en particulier : IgG maternelles
circulantes contre le CMH paternel de classe I dans 20% des premières grossesses et 75-80% des multipares.
Chez la souris, tolérance de la mère pour les allo-Ags paternels dans un modèle de greffe de cellules tumorales.
La souris a une tolérance temporaire vis à vis des allo-Ags du père pendant la grossesse, une fois terminée elle
est capable de les éliminer.
C’est dont une mauvaise hypothèse.
D. Mise en place d’une tolérance materno-fœtale active ?
Nécessité d’une telle tolérance : hypothèse retenue
Foetus = semi allogreffe non rejetée
Tolérance materno-fœtale qui permet au fœtus de se développer en le protégeant de l’action du SI maternel.
Ces mécanismes de tolérance sont mis en place par le fœtus et par la mère.
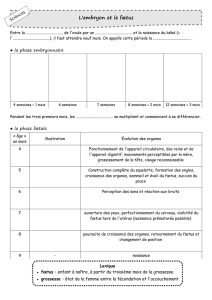
I. Mécanismes de protection développés par le fœtus :
1) Diminution de l’antigénicité du trophoblaste : expression des molécules HLA :
Molécules du CMH de classe I « classiques » à la surface du trophoblaste :
Molécules du CMH de classe I « non classiques » à la surface du trophoblaste :
- Expression des molécules HLA-E et HLA-G
- Expression de HLA-G surtout sur le trophoblaste extravilleux
Rôle particulier supposé dans le processus d’implantation du placenta dans la déciduale maternelle.
HL-G se lie au récepteur Kir (Killer inhibitor receptor) inhibiteur du LNK : celui-ci ne détruit pas le trophoblaste.

Molécules du CMH du type II
Absence totale d’expression de ces molécules sur le trophoblaste
Idem en présence d’un stimuli pro inflammatoire comme l’IFN- = expression absente et non inductible de ces
molécules.
2) Diminution de la prolifération lymphocytaire à l’interface foeto-maternelle : IDO (indoleamine 2,3
dioxygenase)
Produite par le syncytiotrophoblaste fœtal qui envahit l’utérus
Epuisement de nutriments (tryptophane) nécessaires à la prolifération des Ly
Confirmé in vivo : inhibition pharmacologique de IDO chez une souris gravide : perte du fœtus car il est attaqué
par les Ly.
3) Induction de molécules pro-apoptotiques à l’interface foeto-maternelle : expression de CD95L (Fas
ligand)
A l’interface entre tissu placentaire et SI maternel, c’est un mécanisme qui permet la suppression des Ly
activés. Chez les souris qui n’expriment pas CD95L on a une infiltration massive de Ly et nécrose à l’interface
placenta-déciduale, les portées sont plus petites (par perte de certains fœtus).
4) Inhibition de l’action du complément : inhibiteurs du complément :
IgG maternelles contre le CMH paternel présentes dans 20% des 1ères grossesses et 75-80% des multipares.
Or certains de ces Acs peuvent réagir avec le HLA-G :
DAF, MCP et CD59 sur membrane du syncytiotrophoblaste :
- DAF : dissociation de la C3 convertase
- MCP : co-facteur du facteur I (clivage de C4)
- CD59 = protectine = empêche la formation du CAM
Conclusion : Mécanismes de protection du fœtus :
- baisse de l’antigénicité : baisse de
l’expression CMH I et absence CMH II
- production HLA-G et HLA-E pour inactiver
cellules immunitaires
- expression enzymes IDO empêchant la
prolifération lymphocytaire
- expression de CD95L supprimant les Ly
activés
- inhibition de l’activité du complément

II. Mécanismes de tolérance développés par la mère
1. Rôle des NK utérines :
Cellules majoritaires (70%) des cellules immunitaires présentes dans la déciduale. Infiltration des NK dans
l’utérus sous l’effet de la progestérone.
Les uNK s’accumulent tout autour du trophoblaste en début de grossesse puis disparaissent progressivement à
partir de la 20ème semaine absence en fin de grossesse.
Coïncidence entre la période d’invasion du trophoblaste et l’infiltration des NK (placentation achevée à la 20ème
semaine)
Versant immunitaire :
NK utérines et NK du sang périphérique ont des caractéristiques différentes : les récepteurs exprimés à la
surfaces des uNK sont différents de ceux sur les pNK : les uNK expriment des récepteurs inhibiteurs :
CD94/NKG2A (ligand de HLA-E) +++ et des récepteurs inhibiteurs spécifiques de HLA-C de façon beaucoup plus
importante que les pNK.
Associés à une plus faible activité cytotoxiques des uNK.
Prévient la lyse du trophoblaste
Versant implantatoire
Les uNK produisent : angiopoietine + VEF (Vascular Endothelial Growth factor) + PLGF (Placental growth factor)
qui favorisent la vascularisation de la déciduale.
LIF: rôle essentiel dans l’implantation des blastocytes : favorise la décidualisation de l’endomètre + l’invasion
trophoblastiques. Joue sur le contrôle de l’angiogenèse au niveau des villosités trophoblastiques. Expression
maximale contemporaine de la fenêtre implantatoire.
IP10 + IL8 : chimiokines favorisant la migration et l’insertion du trophoblaste dans la muqueuse utérine.
Rq : souris déficiente en NK anomalies d’implantation et placenta hypotrophe par défaut de vascularisation
rôle majeur des NK
Rôle d’autant plus important que chez la femme, le remodelage des artères spiralées est majeur (forte
consommation en O2 du fœtus)
importance des NK utérines qui migrent dans la déciduale vis-à-vis du remodelage vasculaire = étape
majeure de la gestation.
Effet protecteur des uNK pour la mère : contrôlent l’étendue de l’invasion des tissus maternels par le
trophoblastes via l’interaction de ligand paternels ou trophoblastiques avec des récepteurs des uNK. Potentiel
invasif important des trophoblastes : en l’absence de déciduale maternelle leur invasion peut-être incontrôlée :
grossesse extra-utérine.
2. Rôles des DC maternelles :
Coopération entre NKu et cellules dendritiques (DC) :
3. Rôles des macrophages utérins maternels :
Au cours de l’implantation du trophoblaste dans la déciduale, remodelage tissulaire maternel production de
cellules apoptotiques.

Débris cellulaires produits par le trophoblaste = débris potentiellement immunogènes (1/2 HLA paternel)
doivent être éliminés rapidement sinon réaction pro-inflammatoire rôle des macrophages utérins :
éliminent les cellules apoptotiques.
4. Rôle des LT régulateurs
Rappel : Ly T reg ont des fonctions immunosuppressives par différents mécanismes dont : production de
cytokines anti-inflammatoires (IL-10 TGF-ß), par contact direct avec les cellules cibles (apoptose induite,
cytolyse cellulaire)
LyT reg peuvent exercer leurs fonctions sur :
Ly T inhibe prolifération et production de cytokines
LB inhibe production d’Ac,
LNK inhibe activité cytolytique
DC inhibe leur maturation tolérance
Les LyT reg sont présents dans la déciduale (dès le 2ème jour de grossesse) + leur proportion augmente dans les
ganglions qui drainent le tractus urogénital (pas de différence observée dans le sang).
Le mécanisme de recrutement des Treg est mal connu : rôle supposé des hormones dont hCG (hormone
gonadotrophique chorionique) : présente très tôt à l’interface FM, Treg expriment des récepteurs pour hCG, in
vitro hCG peut induire la migration des Treg.
Treg participent à la tolérance materno fœtale :
III. Mécanismes de protection développés par le fœtus et la mère
Production de cytokines aux effets anti-inflammatoires
Le trophoblaste et les cellules de la déciduale
- bloquent la production de TNF- et d’INF- associés au profil Th1 « pro-inflammatoire »
- produisent de l’IL-4, de l’IL-10 et du TGF-ß associés au profil Th2 « anti-inflammatoire »
Le profil Th2 au niveau de l’interface FM favorise l’immunotolérance du fœtus.
 6
6
1
/
6
100%