ch-17-18-19

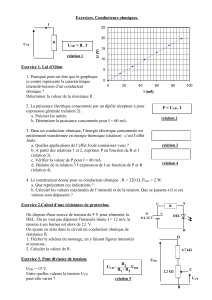
CH.17 RESSOURCES ENERGETIQUES ET ENERGIE ELECTRIQUE
Ressources énergétiques
Les ressources énergétiques renouvelables et non renouvelables sont distinguées par leurs
durées caractéristiques.
Ressources non renouvelables : durée d’exploitation<< durée de reconstitution
Ressources renouvelables : durée d’exploitation >> durée de reconstitution. Un cas
particulier : la durée d’exploitation de l’énergie solaire est quasi illimitée à notre échelle.
Etude énergétique d’un générateur
La tension UPN aux bornes d’un générateur de tension, traversé par un courant électrique
d’intensité I sortant par la borne P est égale à : UPN = E – r.I où UPN en V, I en A, E fem en V et
r, résistance interne en ohm (Ω)
L’énergie électrique fournie Ee par le générateur au reste du circuit pendant la durée Δt est :
Ee = UPN.I.Δt où Ee en J
La puissance électrique Pe du transfert d’énergie par le générateur au reste du circuit est :
Pe = UPN.I où Pe en Watt
Etude énergétique d’un récepteur
L’énergie électrique reçue Ee par le récepteur pendant la durée Δt est : Ee = UAB.I.Δt
La puissance électrique du transfert d’énergie reçue par le récepteur pendant la durée Δ est t
Pe = UAB.I
Effet Joule et conducteur ohmique
Un conducteur ohmique dissipe, par transfert thermique et par rayonnement, toute l’énergie
électrique Ee qu’il reçoit. Ce phénomène s’appelle l’effet Joule. L’énergie dissipée par effet
Joule dans le conducteur ohmique pendant la durée Δt est : Ej = R.I².Δt ; La puissance liée à
l’effet Joule est : ΡJ = R.I²
Loi d’Ohm
La tension UAB aux bornes d’un conducteur ohmique de résistance R, traversé de A vers B par
un courant d’intensité I, est donnée par la loi d’Ohm : UAB = R.I où UAB en volt (V), R en ohm
(Ω), I en ampère (A).
Bilan des transferts d’énergie
Schématisation d’une chaîne énergétique

Ee = énergie électrique reçue par le moteur
Ed = énergie dissipée par effet Joule et par frottement
Em = énergie mécanique transférée par le moteur (qui est la part utile dans la conversation
d’énergie)
Rendement de conversion ή : ή = Eutile/Ereçue avec 0≤ ή < 1
CH. 18 : COMBUSTION ET ENERGIE CHIMIQUE
Réaction de combustion
Lors de la combustion complète un hydrocarbure ou d'un alcool le combustible réagit avec le
comburant (c'est-à-dire le dioxygène) pour former du dioxyde de carbone et de l'eau.
Dans l'écriture d'une équation de combustion commence par ajuster les nombres stoechiométriques
pour vérifier la conservation des éléments carbone et hydrogène ; on vérifie ensuite la conservation
de l'élément oxygène en ajustant les nombres stoechiométriques correspondants.
Exemple : la réaction de combustion du méthane constituant essentiel du gaz de ville s'écrit :
CH4 (g) + 2O2 (g)
CO2 (g) + 2H2O (g) les nombres stoechiométriques sont ajustés de façon à
vérifier la conservation de chaque élément (carbone hydrogène puis oxygène)
Masse de CO2 produit par véhicule
Pour estimer la masse de dioxyde de carbone produite lors d'un déplacement d’un véhicule :
1. évaluer la quantité de matière de combustible consommé
2. écrire l'équation de combustion puis construire le tableau d'évolution
3. calculer l'avancement maximal en considérant que le dioxygène présent dans les temps léger
excès
4. en déduire la quantité de matières plus la masse de CO2 produit
Energie libérée lors d'une combustion
une action de combustion est exothermique
on appelle énergie molaire de combustion l'énergie libérée par 1 mole de combustible
consommé : elle est notée Em,comb et s’exprime en J.mol-1

l’énergie libérée par la combustion complète d'une quantité de matière n de combustible
donnée par la relation : Elib = n * Em,comb n en mole (mol), Em,comb en joule par mole (J.mol-1)
et Elib
Energie chimique
lors des réactions chimiques, les molécules libèrent ou captent de l'énergie : on dit qu'elles
contiennent de l'énergie chimique
les hydrocarbures les alcools constituent des stocks d'énergie chimique. Leur combustion
permet de libérer cette énergie chimique stockée, qui est ensuite convertie en une autre
forme d’énergie
Ordre de grandeur
Changement d’état = 10 à 102 kj.mol-1
Combustion = 103 à 104 kj.mol-1 kj.mol-1
Transformation nucléaire = 1011 à 1013 kj.mol-1
CH. 19 : PILES ET OXYDOREDUCTION
Qu'est-ce qu'une pile ?
Une pile permet de convertir de l'énergie chimique en énergie électrique. L’ énergie
chimique mise en jeu provient d'une transformation chimique.
Une pile est constituée de l'assemblage de deux compartiments : l’un constitue le pôle positif
de la pile, l'autre le pôle négatif. La plupart du temps chaque compartiment contient une
partie métallique et un milieu à caractère ionique, appelée électrolyte. Les compartiments
sont liés par un séparateur permettant le transport des ions.
Une pile saline contient un électrolyte gélifiée constitué d’ions.
Dans une pile alcaline, l'électrolyte est une solution très basique.
Couples oxydant/réducteur
un oxydant une espèce capable de capter un ou plusieurs électrons.
Un réducteur est une espèce chimique capable de céder un ou plusieurs électrons.
Un couple oxydant/réducteur, noté Ox/Red,est l'association d'un oxydant et d'un réducteur
possédant le même élément et susceptibles d'échanger un ou plusieurs électrons selon la
demie équation rédox : Ox + n*e- = Red où n est le nombre d'électrons échangés.
Modèle par transfert d'électrons
lorsque l'on met en contact l'oxydant d'un couple et le réducteur d'un autre couple, une
transformation chimique avoir lieu. Il y a alors transfert direct d'électrons entre les deux
étaie chimique.
Dans une pile, le transfert des électrons se fait par l'intermédiaire du circuit électrique
extérieur. On parle de transfert indirect électrons.
Polarité aux électrodes
schéma
Réaction d'oxydoréduction
équation d'oxydoréduction s'écrit comme la réaction de l'Occident d'un couple oxydant/réducteur
avec le réducteur dans notre couple.

Exemple :
Zn(s) = Zn2+ (aq) + 2e- L’écriture des demi-équations rédox respecte les lois de conservation
des éléments et de la charge électrique.
Cu2+ (aq) + 2e- = Cu(s)
Zn(s) + Cu2+(ap) Zn2+(aq) + Cu(s) Les électrons ne doivent pas apparaître dans
l’équation de la réaction d’oxydoréduction
Vers une production d'énergie maîtrisée
il existe des piles alimentées en continu par les réactifs : les piles à combustible. Les produits
formés sont éliminés de la pile en continu.
Certaines piles sont rechargeables : on les appelle des accumulateurs
1
/
4
100%