LES ACIDES AMINES R – CH – COOH Fonction carboxylique NH2

LES ACIDES AMINES
R – CH – COOH Fonction carboxylique
NH2
Fonction amine
Associés en chaîne, ils donnent des protéines, constituants importants des cellules vivantes.
Cette importance est qualitative (protéines de structures, enzymes) et quantitative (les
protéines représentent 50% du poids sec d’une cellule).
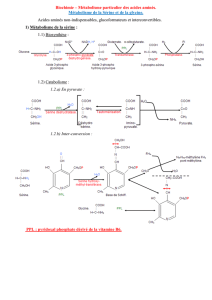
I) Classification des acides aminés
A) Acides aminés à chaîne hydrocarbonée
Glycine => R : H –
Alanine => R : CH3 – (CH3 – CH – COOH : -alaline ; H2N – CH2 – CH2 – COOH
NH2 -alaline)
Valine => R : CH3 – CH –
CH3
Leucine => R : CH3 – CH – CH2 –
CH3
Isoleucine => R : CH3 – CH2 – CH –
CH3
B) Acides aminés à chaîne hydroxydée
Sérine => R : HO – CH2 –
Thréonine => R : CH2 – CH
OH
C) Acides aminés à chaîne soufrée
NH2
Cystine => R : SH – CH2 – CH2 – CH – COOH
S
Cystéine => deux fois la cystine : S
CH2 – CH – COOH
Méthionine => R : CH3 – S – CH2 – NH2
D) Acides aminés carboxyliques
R contient au moins une autre fonction carboxylique.
Acide aspartique => R : HOOC – CH2 –
Acide glutanique => R : HOOC – CH2 – CH2 –
E) Acides aminés basiques
R contient une ou plusieurs fonctions amines.
Acide glutamine => R : H2N – C – CH2 – CH2 –
O
Lysine => R : H2N – CH2 – CH2 – CH2 –

Arginine => R : H2N – C – NH – CH2 – CH2 – CH2 –
O groupement guanidique
F) Acides aminés aromatiques
Phényl-alanine => R : – CH2 –
Tyrosine => R : HO – —
Tryptophane => R :
N
H
G) Acides aminés hétérocycliques
Proline => COOH
N
H HO
Hydroxyproline => COOH
N
H
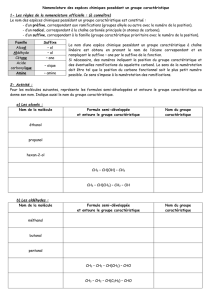
II) Propriétés physico-chimiques des acides aminés
A) Caractère amphotère
On va prendre pour exemple l’acide aminé glycine, H – CH – COOH
NH2
Diagramme de prédominance pour la fonction – COOH
– COOH – COOH et – COO- – COO-
pKa
pH
pKa – 1
COOH
COO
pKa + 1
Diagramme de prédominance pour la fonction – NH2
– NH3+ – NH3+ et – NH2 – NH2
pH
pKa – 1
NH3
NH2
pKa + 1
Diagramme de prédominance pour l’acide aminé
H – CH – COOH H – CH – COOH
NH2 NH2
pKa1-1=3 pKa1=4 pKa1+1=5 pKa2-1=8 pKa2=9 pKa2=10 pH
H – CH – COOH
NH3+
H – CH – COOH
NH3+
H – CH – COO-
NH2
H – CH – COO-
NH3+
H – CH – COO-
NH3+
H – CH – COO-
NH3+
H – CH – COO-
NH2

COOH
COO
NH3
NH2
pH
pKa2
pKa1
V1
2
V1
V1V2
2
V2 VOH-
Cas général :
R—CH—COOH -/+H+ R—CH—COO- R—CH—COO-
pKa1 pKa2
NH3+ NH3+ NH2
A+ A+/- A-
Forme zwitterion, q=0
La forme zwitterion apparaît lorsque la réaction atteint le point isoéléctrique à un certain
pH : pHi.
pHi pKa1pKa2
2
Quand la moitié de —COOH est dissociée, pH1=pKa1.
Quand la moitié de —NH3+ est dissociée, pH2=pKa2.
Au point isoéléctrique, l’ensemble des charges est nul.
A
A
Ka1A/
H
A
et
Ka2A
H
A/
A
A/
H
Ka1
et
A
Ka2A/
H
ainsi :
A/
H
Ka1
Ka2A/
H
donc :
H
2Ka1Ka2
, avec
pH log H
log( Ka1Ka2)
pH 1
2(log Ka1log Ka2)
pH 1
2(pKa1pKa2)
pH 1
2(pKa1pKa2)
=> Titration d’un acide aminé dicarboxylique :
VOH- pour neutraliser H3O+ et - COOH
V2 -V1 ayant réagi avec –NH3+
On ajoute du H3O+ et du HCl
pour tout protoner.

pK1 pK2 pK3
pHi pK1pK2
2
=> Titration d’un acide aminé basique :
pK1 pK2 pK3
pHi pKa2pKa3
2
Exploitation du caractère amphotère :
Electrophorèse
Elle est utile pour séparer différents acides aminés. On trempe du papier, sur lequel on
a fait un dépôt de plusieurs acides aminés et du mélange a séparer, dans une solution
électrolytique dans laquelle on plonge une électrode positive et une électrode négative
reliées à un générateur de 110 ou 220 volts. Les acides aminés positifs vont migrer
vers l’électrode négative et les acides aminés négatifs vont migrer vers l’électrode
positive. Cette distance va dépendre de la tension, de la durée de la manipulation et du
pH de la solution électrolytique (donc de la charge des acides aminés). On va ensuite
traiter le papier avec un colorant pour pouvoir distinguer les tâches correspondant aux
acides aminés ayant migré par rapport à la ligne de dépôt. Les acides aminés neutres
(sous forme zwitterion pour le pH de la solution) restent sur la ligne de dépôt.
Chromatographie échangeuse d’ion
On va démarrer la manipulation à un certain pH, dans une résine chargée
négativement, de sorte que les acides aminés à étudier soit tous chargés positivement
et retenus par la résine. Ensuite, on augmente progressivement le pH et les acides
aminés avec un pHi plus faible se décrochent en se chargeant négativement.
B) Propriétés physiques
1) Point de fusion à 200°C
+H3N—CH—COO- +H3N—CH—COO-
liaison unique
R R
Pour baisser la température de fusion, on transforme —CH—COOH en ester
—CH—C—O—R1
R
COOH
CH2 A+
+H3N—CH—COOH
COOH
CH2 A+/-
+H3N—CH—COO-
COO-
CH2 A+/- -
+H3N—CH—COO-
COO-
CH2 A- -
H2N—CH—COO-
NH3+
(CH2)4 A++
+H3N—CH—COOH
NH3+
(CH2)4 A++/-
+H3N—CH—COO-
NH3+
(CH2)4 A+/-
H2N—CH—COO-
NH2
(CH2)4 A-
H2N—CH—COO-

2) Solubilité
La plupart des acides aminés sont solubles dans l’eau excepté la leucine, tyrosine et cystine,
seulement pour des pH extrêmes.
3) Absorption des UV
OH — —R -/+ H+ -O— —R
273 nm 293 nm
4) Isomérie optique
Forme D ou L (on trouve principalement des formes L)
C) Propriétés chimiques des acides aminés
1) Réactions dues à la présence de groupement carboxylique
Formation de sel :
R—CH—COOH Na+ OH- R—CH—COO- Na+ R—CH—COO-
NH3+ NH2 NH3+
Fonction de formation d’esters : O
R—CH—COOH + HOC2H5 R—CH—C—O—C2H5 + H2O
NH3+ NH3+
Cette fonction « protège » la fonction amine.
Formation d’amides :
—C—NH2 R—NH2
O Amide Amine O O
R—CH—COOH HOC2H5 R—CH—C—O—C2H5 + H2O NH3 R—CH—C—NH2 +
NH3+ NH3+ NH3+
Formation de chlorure d’acide :
—C—Cl
O
(Panchlorure de phosphate)
R—COOH + PCl5 R—C—Cl
ou SOCl2
(chlorure de thyonyle) O
dégagement gazeux de SO2 et HCl
Formation d’alcool aminé :
C2H5
R—CH—COOH
NH
C=O
CH3
R—CH—C—Cl
NH O
C=O
CH3
PCl5
SOCl2
 6
6
 7
7
1
/
7
100%