Neurologie de l`action et de la motivation

S 10
L’Encéphale, 2006 ;
32 :
10-24, cahier 2
Neurologie de l’action et de la motivation :
de l’athymhormie à l’hyperactivité
M. HABIB
(1)
(1) Service de Neurologie Pédiatrique, CHU Timone, 13385 Marseille cedex 5.
INTRODUCTION
La neurologie du comportement a connu, ces dernières
années, une croissance considérable, passant par là
même du statut de branche mineure de la neuropsycho-
logie, à celui de discipline médico-scientifique à part
entière. Dans cette évolution récente, deux figures mar-
quantes de la neurologie du
XXe
siècle ont indubitable-
ment joué un rôle majeur : Norman Geschwind (32), qui
a en quelque sorte établi les fondements de la discipline
en montrant que des perturbations psychiques profondes
pouvaient être expliquées par une séparation physique,
une déconnexion, entre deux zones cérébrales distinctes,
et Antonio Damasio (18), qui a définitivement fait admettre
le modèle de l’humain cérébro-lésé comme un vecteur pri-
vilégié de notre compréhension de l’un des grands mys-
tères du fonctionnement mental de l’Homme : les liens
entre l’intelligence et l’émotion. Mais alors que Damasio
et son école ont ainsi largement contribué à nos connais-
sances actuelles de la fonction émotionnelle des lobes
frontaux en particulier, nous savons encore relativement
peu de chose sur le rôle des ganglions de la base, si ce
n’est que leur intervention se fait essentiellement en tant
qu’interface entre émotions et action, ce qu’on qualifiera
volontiers de motivation (37). C’est donc à ce sujet que
sera consacrée la première partie de cet article, en rap-
pelant les principales étapes qui ont permis à la neurologie
comportementale de contribuer de manière déterminante
à la problématique du substrat cérébral de la motivation
humaine.
C’est également à Geschwind que l’on doit d’avoir initié
un développement encore plus récent de la discipline,
celui qui concerne la mise en place des systèmes neuro-
cognitifs au cours de la maturation du cerveau, ce que l’on
dénomme volontiers aujourd’hui la neuropsychologie du
développement. Geschwind, par sa grande intuition clini-
que, avait remarqué que les enfants en difficulté d’appren-
tissage avaient souvent quelques caractéristiques qui
laissaient penser que le développement du cerveau pou-
vait se faire chez eux de façon atypique, et a imaginé plu-
sieurs scénarios par lesquels l’évolution avait pu continuer
à sélectionner des individus exceptionnels, soit du fait de
déficits sectorisés de leurs fonctions cognitives, soit au
contraire du fait de talents particuliers les plaçant au-des-
sus de la moyenne de leurs pairs dans d’autres domaines
du fonctionnement intellectuel. Un représentant exem-
plaire de ces cerveaux atypiques est certainement l’enfant
hyperactif, qui a par la suite fait l’objet de nombreuses étu-
des largement influencées par le fait qu’il s’agit pratique-
ment de la seule pathologie en neurologie du développe-
ment qui soit sensible à l’effet d’une famille de
médicaments, les amphétamines. C’est donc surtout à tra-
vers cette approche pharmacologique que la neurologie
s’est jusqu’ici seulement intéressée à la question. La
deuxième partie de cet article nous démontrera qu’une
approche inspirée de la neurologie du comportement, par
analogie avec les connaissances obtenues chez l’adulte
cérébro-lésé, peut s’avérer, ici également, très fruc-
tueuse.
ATHYMHORMIE ET GANGLIONS DE LA BASE
Vers la fin des années 80, nous avions été frappés, mon
collègue Michel Poncet et moi-même (38), par les modi-
fications comportementales que nous avions observées
chez deux patients, porteurs de lésions similaires confi-
nées dans la partie antérieure des noyaux gris centraux.
La principale caractéristique de ces lésions, outre leur
nature vasculaire particulière (lacunes cérébrales) que
nous ne discuterons pas ici, était précisément de concer-
ner exclusivement, mais de façon bilatérale, la tête du
noyau caudé et la substance blanche avoisinante, et ce
de façon étonnamment discrète par rapport à l’intensité
des modifications comportementales.

L’Encéphale, 2006 ;
32 :
10-24, cahier 2 Neurologie de l’action et de la motivation : de l’athymhormie à l’hyperactivité
S 11
Un « nouveau » syndrome neurologique
En effet, les deux patients, deux hommes dans leur sep-
tième décennie, avaient, selon leur entourage, et selon
leurs propres dires, radicalement changés de personna-
lité, après ce qui s’est avéré être une succession de petites
lacunes, probablement liées à une hypertension ancienne
méconnue. Alors qu’ils étaient tous deux des personnes
très actives, très impliquées dans leur profession comme
dans leur vie familiale, ils étaient devenus, à la suite de
ces lésions, totalement inertes, apathiques, inactifs et
sans plus aucun indice apparent de ce que Dide et Guiraud
(22) dénommaient l’élan vital, sans doute par analogie
avec le concept bergsonnien du début du siècle. Cette
apathie, cette absence d’activité spontanée, se doublait
également de deux aspects qui se sont ensuite imposés
comme des éléments fondamentaux du syndrome : une
apparente indifférence affective, ou du moins une incapa-
cité de l’environnement usuel à provoquer les actions
habituelles soit de recherche du plaisir soit d’évitement
des désagréments, et une absence de pensées sponta-
nées, véritable vide mental, parfois impressionnant par
son intensité. Ainsi un des deux patients, professeur d’uni-
versité en activité avait pu rester près d’une heure immo-
bile face à son examinateur, lui-même occupé à compul-
ser ses dossiers, sans poser aucune question, sans la
moindre marque d’impatience ni de curiosité face à
l’incongruité de la situation. Au contraire, lorsque après ce
long moment l’examinateur lui demanda comment il se
sentait, il répond « parfaitement bien » et à quoi il avait
pensé pendant toutes ces minutes, « à rien, absolument
à rien ». L’autre patient était resté 24 heures sans s’ali-
menter, attendant patiemment que son épouse le lui pro-
pose, mais mangea ensuite d’un appétit normal le plateau
qu’elle lui amena. D’autres cas similaires de lésions bicau-
dées ont également été ensuite publiés qui portaient les
mêmes caractères cliniques (48, 75). Kumral
et al.
(48)
ont ainsi collecté 25 cas de lésions caudées, dont 15 pré-
sentaient ce qu’ils appellent une « aboulie », qu’ils défi-
nissent comme «
decreased spontaneous activity, prolon-
ged latency in responding to questions, fatigue, and an
aversion to any activity
». On voit bien là la nature très spé-
ciale de ce tableau, surtout lorsqu’on réalise que les capa-
cités sous-jacentes sont intactes : les patients ne bougent
pas spontanément, restent des heures dans la même
position, mais si on les incite à se déplacer, ils le font très
facilement, souvent même de manière anormalement
docile. De même si on les interroge sur leurs connaissan-
ces, leur mémoire et si on mesure leurs aptitudes intellec-
tuelles, on s’aperçoit que celles-ci sont étonnamment res-
pectées, parfois supérieures, et qu’en tout cas l’on n’a pas
affaire à des personnes souffrant de troubles cognitifs au
sens habituel du terme. Certes, les capacités attention-
nelles, l’empan numérique et certaines épreuves exécu-
tives comme le test de Wisconsin peuvent être altérés,
mais globalement, on ne retrouve pas les déficits habi-
tuellement retrouvés lors de lésions frontales, surtout cel-
les accompagnées de tels états d’apathie, comme lors de
démence avancée, ou de dégâts traumatiques sévères
des lobes frontaux. Ici, du reste, le cortex frontal est intact
et même la substance blanche des lobes frontaux est dans
sa majeure partie préservée. Ce tableau nous amena
même à reconsidérer un concept qui était à l’époque très
couru, celui de démence sous-corticale ; certes les lésions
étaient sous-corticales, mais on ne retrouvait pas la dis-
tinction alors classique entre fonctions instrumentales
intactes et fonctions basiques ou exécutives altérées : ici,
ni l’attention, ni la mémoire, ni même les apprentissages
procéduraux n’étaient significativement atteints, et du
reste, on ne pouvait pas parler de démence puisque les
tests neuropsychologiques n’étaient pas significativement
déficitaires. Et pourtant le handicap était majeur, faisant
de ces personnes intellectuellement et physiquement
« normales » de grands handicapés dans leur vie quoti-
dienne, totalement dépendants d’autrui pour survivre.
Résurrection d’un ancien concept : l’athymhormie
En fait, la nature du déficit rappelait plutôt celui de cer-
tains patients schizophrènes, volontiers qualifiés de défi-
citaires aujourd’hui, jadis appelés hébéphrènes, et à pro-
pos desquels Dide et Guraud (22) avaient créé le terme
d’
athymhormie
, des deux racines grecques
ορµη
(hormé),
qui signifie élan, impulsion, et
θυµος
(thumos), qui signifie
sentiment, humeur [pour une revue exhaustive de l’histo-
rique du concept, voir l’excellent papier de Luauté et Sala-
dini (52)]. De fait la ressemblance est troublante entre les
deux types de pathologie, l’une psychiatrique, l’autre neu-
rologique, au point que si l’on n’avait la certitude des
lésions cérébrales, et surtout de la survenue
de novo
du
trouble à la suite de ces lésions, on pourrait aisément envi-
sager certains diagnostics psychiatriques, la schizophré-
nie, mais aussi et peut-être surtout la dépression, avec
laquelle l’athymhormie partage beaucoup de points
communs : l’apathie comportementale, un certain degré
d’aboulie, qui caractérise souvent le déprimé, le désinté-
rêt, parfois total et profond ; mais c’est surtout au niveau
des émotions et de la vie psychique en général que se
situe précisément la différence, entre l’athymhormique qui
n’a aucune pensée spontanée, et s’en trouve plutôt bien,
et le déprimé qui ressasse ses pensées négatives, voire
morbides, et qui souffre proportionnellement à l’intensité
de son activité mentale. Du reste, dans une de nos obser-
vations publiées par la suite (37), nous rapportions le cas,
illustrant bien cette différence, d’un homme de 35 ans qui
à la suite d’une affection cardiocirculatoire, avait présenté
deux accidents ischémiques, le premier ayant détruit la
tête du noyau caudé gauche, et dont les conséquences
neuropsychologiques avaient été pratiquement inexistan-
tes, hormis une dépression sévère ayant nécessité plu-
sieurs hospitalisations, avant que ne survienne une
deuxième lésion, dans la profondeur de l’hémisphère
droit, dont les conséquences ont été l’apparition d’un
tableau athymhormique typique et sévère et la totale dis-
parition de tout symptôme dépressif, en particulier au
niveau de son vécu douloureux dont sa femme nous rap-
portait « qu’il avait disparu, comme par enchantement ».
Enfin l’athymhormique rapporte souvent ressentir les
émotions normalement, ce sont ses envies, ses désirs qui

M. Habib L’Encéphale, 2006 ;
32 :
10-24, cahier 2
S 12
ont disparu, un élément qui, joint à la notion de vide mental,
apporte un argument décisif au diagnostic (35). C’est
pourquoi le terme d’apathie, parfois employé pour dési-
gner des perturbations proches, surtout rencontrées lors
de syndromes démentiels (53-55) paraît moins approprié
car il insiste seulement sur la composante d’insensibilité
émotionnelle, qui n’est ici qu’apparente, au contraire de
sujets souffrant de lésions bi-amygdaliennes (2).
En définitive, un tableau clinique marqué par deux
contrastes : celui d’un handicap majeur provoqué par des
lésions cérébrales de volume somme toute minime, et
celui d’une altération majeure de la vie mentale, sans
modification notable des fonctions intellectuelles classi-
ques, contrairement à ce que l’on rencontre dans à peu
près toutes les autres localisations lésionnelles en neuro-
logie.
Les nécroses pallidales et le « PAAP »
Pourtant, ce tableau nous a d’emblée évoqué d’autres
observations, publiées quelques années auparavant par
Dominique Laplane
et al.
(49, 50), à Paris, puis par André
Ali-Chérif
et al.
(4) à Marseille. Dans cinq observations
similaires, ces auteurs avaient rapporté un syndrome qu’ils
avaient qualifié de « perte de l’autoactivation psychique »
(PAAP), pour souligner le contraste entre l’apparente inca-
pacité à agir spontanément, et une capacité intacte à agir
sur incitation extérieure, comme si un système intact ne
pouvait plus se mettre en action spontanément, et avait
besoin, en quelque sorte, d’une « activation » extérieure.
Cette notion d’activation sera du reste, nous le verrons, au
creux d’un débat particulièrement animé.
Pour le reste, le tableau était très proche de nos obser-
vations de lésions caudées, sauf que la lésion était ici le
plus souvent de nature anoxique ou par intoxication à
l’oxyde de carbone et dans une localisation plus ventrale
et postérieure : le pallidum. Chez la plus jeune patiente
d’Ali-Chérif
et al.
, qui avait été revue 7 ans plus tard, une
IRM avait pu être réalisée, montrant clairement que
l’intoxication avait détruit bilatéralement l’extrémité
médiane de ce noyau, le pallidum interne, offrant ici encore
un contraste flagrant entre la petitesse des lésions et
l’intensité du tableau clinique. Cette jeune femme de
19 ans qui, après quelques semaines de convalescence
de son intoxication initiale, avait frappé son entourage par
son intense apathie et sa totale absence d’initiative, même
la plus élémentaire : laissée un matin sur la plage à l’ombre
d’un parasol, elle était restée une journée entière au soleil,
parfaitement éveillée, mais totalement immobile, incapa-
ble même de se retourner pour suivre l’ombre du parasol,
de telle sorte qu’elle dut être hospitalisée, le soir venu,
pour des brûlures au second degré. Sept ans plus tard,
l’inertie et l’apathie étaient identiques, mais alors que les
capacités intellectuelles étaient jugées intactes en début
d’évolution, elles s’étaient significativement altérées de
manière globale au bout de 7 ans, avec un effondrement
du QI et des capacités d’apprentissage, sans doute par
absence prolongée de toute activité mentale. En effet, le
vide mental était, dès le début, total et profond, de sorte
qu’à moins d’être stimulée, elle ne rapportait aucune pen-
sée spontanée, une condition bien singulière dont on peut
penser qu’elle ne favorise pas l’exercice des fonctions
cognitives !
Un débat neurophilosophique
Ces observations posent au neurologue, et au scienti-
fique en général, deux questions cruciales, dont la portée
dépasse certainement la science même, pour atteindre les
confins de la philosophie. La première est celle des liens
entre l’activité motrice, l’action volontaire en général, et
l’activité mentale, cette dernière étant conçue, non comme
la cognition au sens habituel – l’ensemble des mécanis-
mes permettant de traiter une information à un niveau éla-
boré d’abstraction –, mais, en amont de la cognition, un
mécanisme capable de produire, avant tout traitement
cognitif, une pensée non encore différenciée. À cet égard,
ces observations nous délivrent deux enseignements
majeurs : 1) il existe effectivement un mécanisme en
amont de la cognition, puisque celui-ci peut être spécifi-
quement altéré à la suite d’une lésion cérébrale, un méca-
nisme autonome et spontané, ayant pour rôle de produire
une
activité
mentale indifférenciée, avant même que celle-
ci ne devienne un
état
mental ou encore une fonction men-
tale spécifique ; 2) ce mécanisme partage largement ses
origines avec celui qui permet la production d’
actions
spontanées, suggérant une nature commune entre la pro-
duction de pensées spontanées et d’actions spontanées,
et, par là même, obligeant à explorer encore plus en amont
quelle pourrait être cette nature commune, probablement,
proposions-nous, une fonction basique appelée
motiva-
tion
.
La deuxième question, sans doute moins profonde et
plus anecdotique, a toutefois animé les colonnes de
Revue Neurologique pendant plusieurs années, car elle
touche à un point sensible en neurophilosophie, celui de
la spécificité humaine de la pensée. Schématiquement,
le débat peut se résumer en ces termes : le patient
athymhormique a-t-il une pensée propre, intacte, qui ne
peut seulement pas se mettre spontanément en route car
il lui manque un système activateur, probablement sous-
cortical, qui allumerait en quelque sorte un fonctionnement
cortical intact mais inactif ? La pensée humaine garde
alors toute sa spécificité, elle a seulement besoin d’un
« moteur » voire même d’un « démarreur » pour se mettre
en route, un peu comme on conçoit le système réticulaire
activateur ascendant dans son rôle dans la vigilance, res-
ponsable de l’éveil quand il est action, et laissant place
au sommeil, lorsque son action cesse. Ou bien n’y a-t-il
pas dans le cerveau, sans doute abrité au sein de ces
structures sous-corticales, un mécanisme spécifique, très
probablement alors commun à tous les vertébrés, large-
ment sous-tendu par la notion archaïque de satisfaction
des besoins élémentaires, qui ramènerait l’homme au
même rang que les autres espèces douées non pas
nécessairement de volonté mais de la simple capacité à
initier spontanément une action ? Cette éventualité ne va

L’Encéphale, 2006 ;
32 :
10-24, cahier 2 Neurologie de l’action et de la motivation : de l’athymhormie à l’hyperactivité
S 13
pas sans rappeler le système hormothymique postulé par
Dide et Guiraud, « représentant le dynamisme d’une ten-
dance à satisfaire les besoins primordiaux » (22, 33). On
conçoit que cette simplification, sans doute excessive, de
l’esprit humain puisse choquer dans la mesure où elle
ramène la spécificité de la pensée humaine et le libre-arbi-
tre à un simple sous-produit évolutif d’une fonction moti-
vationnelle basique et universelle.
Nous n’entrerons pas plus ici dans ce débat, si ce n’est
pour signaler que la suite des événements, en particulier
l’apport des travaux récents d’imagerie fonctionnelle, ont
largement donné raison à ce dernier point de vue en
démontrant l’existence et le rôle décisif de structures sous-
corticales organisées en circuits spécifiques à la fonction
de motivation.
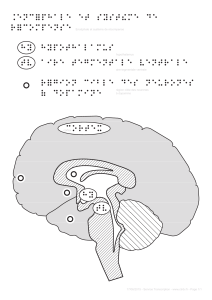
L’anatomie de la motivation
Le point le plus intéressant pour notre présent propos,
est la mise en évidence d’une entité anatomo-fonction-
nelle individualisable chez l’homme dans une fonction
jusqu’ici probablement sous-explorée, voire sous-esti-
mée, la motivation.
Chez l’animal déjà, une littérature spécifique avait dès
cette époque commencé à explorer les bases neurales de
la motivation, avec comme toile de fond les expériences
d’auto-activation comportementale chez le rongeur.
En plaçant des électrodes à des sites cérébraux stra-
tégiques, les expérimentalistes des années 60 avaient pu
mettre en évidence un circuit sur le trajet duquel des élec-
trodes reliées à une pédale accessible à l’animal don-
naient lieu à une tendance de l’animal à s’autostimuler
(63). Ce circuit de l’autostimulation a pu être décrit avec
précision grâce à la découverte de l’importance fonda-
mentale pour son fonctionnement d’un neuromédiateur,
la dopamine, et tout particulièrement le système méso-lim-
bique qui prend son origine dans les neurones dopami-
nergiques de l’aire tegmentale ventrale, dans la partie
haute du tronc cérébral, traverse l’hypothalamus latéral
avant de se terminer dans les régions pré-optiques et dans
le noyau accumbens. Ce dernier noyau a pris ces derniè-
res années une importance considérable de sorte qu’il est
actuellement considéré comme la plaque tournante des
« systèmes cérébraux de la récompense » (15).
Noyau accumbens et systèmes cérébraux
de la récompense
Le noyau accumbens est une structure sous-corticale
faisant partie du striatum, et plus particulièrement du stria-
tum limbique. Il forme le lit du striatum, d’où son nom, et
se situe chez l’homme à la partie ventrale de la tête du
noyau caudé, qu’il continue par la partie la plus antérieure
du putamen. Il projette ensuite sur une partie ventrale du
pallidum, formant ce qu’on appelle parfois le pallido-stria-
tum ventral ou limbique. Le terme de limbique provient du
fait qu’il reçoit des afférences de toutes les principales por-
tions du système limbique : le cortex frontal médial et orbi-
taire, l’amygdale, et l’hippocampe. Il apparaît ainsi comme
la partie du striatum appartenant au système limbique. Il
est divisé en deux sous-régions distinctes (21) : une partie
ancienne, la coque, liée aux structures limbiques primai-
res, et le cœur, plus récent, relié à des structures plutôt
impliquées dans la cognition et le contrôle moteur. La
coque joue un rôle important dans la motivation et l’affect,
servant de substrat au conditionnement pavlovien, à la
réaction à la nouveauté, au contrôle de l’alimentation (de
la mère envers sa progéniture), et au plaisir gustatif. En
outre, la coque semble être l’impact principal de l’action
renforçatrice de l’abus de drogues (80). C’est le lieu pri-
vilégié (56) dans les expériences d’auto-injection de
cocaïne (de même que dans les expériences d’auto-sti-
mulation, il s’agit ici de mettre en place, en lieu et place
des microélectrodes de stimulation, des micropipettes
délivrant de la cocaïne). À l’inverse, le cœur du noyau n’est
pas directement concerné par l’effet des drogues, mais
sert plutôt à l’apprentissage et à l’expression des compor-
tements dirigés par la valeur attractive de récompenses
attendues. En particulier, le cœur de l’accumbens est
essentiel aux comportements adaptatifs, promouvant la
réponse à des récompenses différées (40).
Globalement, on reconnaît au noyau accumbens
comme rôle de réaliser l’interface entre la motivation et
l’action, véritable plaque tournante entre les systèmes en
charge de la perception et de l’intégration des émotions,
et ceux en charge de l’action déclenchée par ces émotions
(59), ces mêmes systèmes étant par ailleurs impliqués à
la fois dans les mécanismes du conditionnement, tout par-
ticulièrement dans ses deux dimensions : le renforcement
et l’extinction (40), et dans les mécanismes de l’accoutu-
mance aux drogues et de l’addiction (81).
Au-delà du noyau accumbens lui-même, il semble que
le système de la récompense fonctionne sous la forme
d’une boucle cortico-sous-corticale comportant plusieurs
étapes tout à fait symétriques de celles du reste des gan-
glions de la base (3, 17). Dès les années 70, une des prin-
cipales révélations concernant les ganglions de la base a
été la description de ces boucles parallèles, dont le nom-
bre varie selon les descriptions, mais qui fonctionnent tou-
tes selon le même modèle anatomique : une origine dans
une région fonctionnelle précise du lobe frontal, une pre-
mière étape dans le striatum, une seconde dans le palli-
dum, une troisième dans le thalamus, puis retour vers le
cortex d’origine. Cette organisation a été d’abord décrite
pour le système moteur, partant du cortex pré-moteur et
y retournant après des relais dans le putamen, le pallidum
externe et le thalamus ventro-postéro-latéral. Une
deuxième boucle, volontiers qualifiée de cognitive prend
son origine dans le cortex frontal dorso-latéral, celui-là
même auquel on attribue traditionnellement les fonctions
« cognitives » du lobe frontal (anticipation, programma-
tion, contrôle attentionnel, mémoire de travail…), incluant
celles appelées fonctions exécutives, et enfin la boucle
dite limbique, originaire des parties limbiques du cortex
frontal, soit le cortex cingulaire et le cortex pré-frontal
médio-orbitaire, et projetant successivement sur le stria-

M. Habib L’Encéphale, 2006 ;
32 :
10-24, cahier 2
S 14
tum ventral, le pallidum ventral (ou limbique) les parties
médianes du thalamus et finalement retournant vers le
cortex paralimbique d’origine.
En fait, des développements plus récents dans la des-
cription de cette anatomie amènent à distinguer au sein
du circuit limbique, en fait deux circuits différents
(figure 1)
: le circuit cingulaire, qui projette sur le noyau
caudé médian, mais aussi sur le noyau accumbens, et qui
serait plutôt impliqué dans la régulation des actions et de
leur initiation, en particulier dans le choix entre plusieurs
options, et le circuit préfrontal orbitaire médian, qui projette
sur le noyau accumbens, plus particulièrement impliqué
dans l’évaluation du résultat des actions, et en particulier
dans la possibilité de différer la récompense pour pouvoir
en obtenir une plus forte (73).
Contribution de l’imagerie fonctionnelle
Au cours de ces deux dernières années, un nombre
important de travaux d’imagerie fonctionnelle chez
l’homme a été consacré aux mécanismes de la récom-
pense et ont globalement largement confirmé le rôle sin-
gulier de l’accumbens. Celui-ci est en effet spécifiquement
activé dans de nombreuses expériences impliquant
l’octroi au sujet d’une récompense (ou parfois d’une puni-
tion ou d’une non-récompense). En particulier, divers
auteurs ont montré que l’accumbens est activé lorsque le
sujet est averti de l’octroi d’une récompense et à un moin-
dre degré lorsqu’il reçoit la récompense (24, 43, 44, 62).
Une première dissociation a été décrite entre l’anticipation
d’une récompense, qui active seulement l’accumbens, et
l’octroi de la récompense qui active également le cortex
médial frontal (44). Une autre dissociation concerne la pré-
dictibilité ou non de la récompense : pour une récompense
non prédictible, l’activation de l’accumbens est significa-
tive, alors qu’elle ne l’est pas lorsque la récompense est
prédictible [un stimulus sur deux, par exemple (10)]. Cette
constatation est à l’origine de l’hypothèse selon laquelle
le rôle du noyau accumbens serait essentiellement d’éva-
luer l’erreur d’une prédiction de récompense (46). Le
noyau accumbens serait également particulièrement
impliqué dans les phénomènes de sélection lors de choix
entre des actions à haut risque ou à bas risque de perte
(28).
FIG. 1. —
Différentes localisations lésionnelles au cours de syndromes athymhormiques : A) lacunes bi-caudées ; B) nécrose
bipallidale (intoxication oxycarbonée) ; C) double lésion ischémique, pallidum à droite, tête du caudé à gauche.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%