Techniques chromatographiques : la CCM

Techniques chromatographiques : la CCM
- données techniques fondamentales pour réaliser des chromatographies en phase liquide sur
couche mince (CCM) ;
- applications à des chromatographies d'adsorption en phase liquide sur phase stationnaire
solide très fortement polaire (phase stationnaire gel de silice).
Voici quelques données théoriques et techniques générales concernant les CCM.
1. Généralités concernant la CCM
La CCM correspond à de la chromatographie liquide (la phase mobile est un liquide) pour laquelle la
phase stationnaire se présente sous la forme d'une couche plane de faible épaisseur devant sa surface.
CCM se traduit en anglais par TLC (thin layer chromatography) En CCM classique on utilise
généralement la capillarité comme moteur de la phase mobile ce qui implique l'utilisation de phases
stationnâmes présentant une résistance à l'écoulement faible et donc une granulométrie assez élevée et
donc une capacité de séparation pas toujours élevée.
Mais il existe des système de CCM qui mettent en œuvre des appareillages de pompage de la phase
mobile. On peut ainsi utiliser des phases stationnaires de granulométrie faible à très haute performance.
On parle alors de HPTLC : high performance thin layer chromatography.
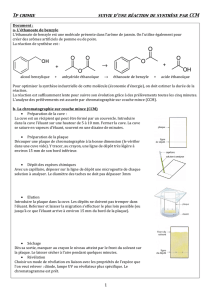
Une manipulation de CCM peut se résumer à l'aide du schéma suivant :
En CCM, pour un système chromatographique donné (nature de la phase stationnaire et de la phase
mobile), chaque analyte révélé possède un Rf (rapport au front de migration) qui lui est propre. En effet,
Rf traduit le jeu des rétentions/élutions différentielles avec la phase stationnaires et la phase mobile.
Fanny Demay – BTS BioAnalyses & Contrôles 1/5

Évidemment 2 molécules différentes peuvent avoir le même Rf, attention aux identifications trop
rapides ... Une molécule absolument non entraînée par la phase mobile conduit à un Rf de 0.
Une molécule absolument non retenue par la phase stationnaire conduit à un Rf de 1.
Une molécule qui passe statistiquement x% de son temps dans la phase mobile et (1-x)% de son temps
retenue par la phase stationnaire conduit à un Rf de x%.
Un problème classique rencontré en CCM est le suivant : quelle est la quantité à déposer ? Si un dépôt
ne contient pas assez de matière on risque d'être en dessous du seuil de détection de la technique de
révélation. Si un dépôt est trop chargé, on risque de saturer la phase mobile lorsqu'elle atteindra la ligne
des dépôts en début de migration : tout se passera alors comme si on réalisait une suite de dépôts à la
queue leu-leu : on observera un effet de traînée.
Évidemment la performance d'une CCM dépend du choix de la phase stationnaire, de la phase mobile et
de la méthode de révélation face au problème chimique posé.
A l'heure actuelle les CCM sont quasiment toutes réalisées sur le support gel de silice (une phase
stationnaire très polaire). Le support papier (phase stationnaire = cellulose avec sa couche d'eau liée =
phase polaire) est un support historique (mais on peut citer l'analyse œnologique des produits de la
fermentation malolactique toujours pratiquée sur papier buvard).
Les CCM demeurent aussi des techniques « micropréparatives » intéressantes (par exemple la
préparation d'extraits lipidiques) : on « gratte » les spots après migration pour récupérer les analytes qui
seront solubilisés dans un solvant adéquat puis on centrifuge pour éliminer le culot de gel de silice.
2. Pratique de la CCM : cas du support gel de silice
2.1. La phase stationnaire gel de silice
Le gel de silice est un adsorbant très polaire (il retient donc a priori les motifs polaires par
interactions faibles de surface). On l'utilisera donc avec une phase mobile de polarité
inférieure.
Pour réaliser des CCM très reproductibles sur gel de silice, il convient de travailler avec des
gels préalablement déshydratés (élimination de l'eau évaporable adsorbée en surface du gel)
par séjour à 110°C. On parle de réactivation du gel pour qualifier cette étape.
Ne jamais mettre ses doigts au contact de la plaque CCM ! On peut utiliser des gants !
Remarque : lorsqu'on réalise des chromatographies sur papier-cellulose, la phase stationnaire
est en fait constituée par l'eau liée à la cellulose. Il ne faut donc surtout pas réactiver.
2.2 Préparer la cuve de chromatoqraphie
Avec moins de 1 cm de hauteur de phase mobile. Il faut laisser saturer l'atmosphère de la cuve en
vapeur de phase mobile ce qui implique une fermeture étanche et du temps... Sinon les migrations
seront perturbées par les courants latéraux d'évaporation de la phase mobile. (L'idéal consiste même à
tapisser la paroi de la cuve avec du papier imprégné de phase mobile.)
2.3. Organiser la phase stationnaire pour les dépôts
Réaliser un tracé au crayon graphite vers 1,5 cm du bord inférieur de la plaque de gel de silice. Prévoir
les emplacements des différents spots de dépôt de façon raisonnée judicieuse en sachant que les
dépôts doivent être à au moins 0,5 cm du bord de la plaque et distants d'au moins 0,8 cm. Reproduire le
plan des dépote sur |e compte-rendu de manipulation.
2.4 Réaliser des dépôts convenables
Pour des CCM analytiques (non préparatives), le diamètre des spots de dépôts doit être de 2 à 3 mm.
Le principe pour réaliser des dépôts convenables est le suivant :
- déposer suffisamment de matière à analyser pour avoir des tâches de migration détectées par la
technique de révélation (donc cela dépend de la détectabilité de la technique de révélation) ;
- ne pas déposer trop, sinon on risque de saturer la solvant de migration lorsqu'il atteindra le spot de
dépôt ce qui entraînera une migration avec tramée.
Fanny Demay – BTS BioAnalyses & Contrôles 2/5

Ainsi, l'optimisation des dépôts est empirique et dépend de chaque manipulation. Une règle importante :
on peut superposer des dépôts si on pense que les solutions à déposer ne sont pas suffisamment
concentrées mais à condition de bien sécher entre chaque application (ceci afin de ne pas étaler les
dépôts au lieu de les superposer). On sèche au thermoventilateur.
Pour appliquer un dépôt, utiliser un tube capillaire convenablement essuyé ou une pipette automatique
réglée vers 0,5µL avec des pointes très fines (dites « crystals »). Tenir le capillaire ou la pointe
perpendiculairement à la plaque de CCM, faire attention à ne pas abîmer le support en déposant.
2.5 Placer en cuve et laisser migrer
- pas de turbulences, pas de vagues...
- vérifier qu'au départ, la Iigne de dépôt est bien au-dessus du niveau de solvant !
- refermer immédiatement la cuve après introduction de la plaque ;
- laisser migrer tant que le front de phase mobile progresse mais arrêter avant que le front de solvant
n'atteigne l'extrémité supérieure de la plaque.
2.6 Révéler la CCM
- marquer le front de solvant dès la sortie de la plaque, au crayon graphite ;
- évaporer soigneusement la phase mobile de la plaque (« séchage » de la plaque) ;
- révéler selon la technique ad hoc (avec ses caractéristiques propres de détectabilité et de
spécificité ...) ;
- entourer les spots révélés au crayon, annoter éventuellement au crayon graphite, marquer les centres,
calculer éventuellement les Rf (rapports au front de migration).
Mise au point d'une phase mobile en analyse par chromatographie sur
couche mince (CCM).
Séparation et identification des acides aminés d'un mélange
pharmaceutique par chromatographie d'adsorption sur couche mince de gel
de silice.
Le but du travail proposé est de rechercher une phase liquide adéquate pour une analyse CCM de gel
de silice destinée à la mise en évidence simple de la composition en acides aminés d'un produit
pharmaceutique: le SARGENOR. Ce médicament se présente sous forme d'ampoules buvables de 10
ml d'un mélange d'acide aspartique et d'arginine.
Matériel de CCM et réactifs disponibles
- Deux plaques de chromatographie de gel de silice (voir les propriétés dans le document de cours).
C'est un adsorbant très polaire (elle retient donc a priori les motifs polaires par interactions faibles de
surface). On l'utilisera donc avec une phase mobile de polarité inférieure.
- Dilution du contenu d'une ampoule de SARGENOR dans 190mL d'eau distillée ;
- Solutions aqueuses de différents acides aminés à 1 mg/mL: respectivement leu, val, phe, tyr, arg, asp,
pro, lys, ser.
- Réactif de révélation à la ninhydrine prêt à l'emploi ;
- Les trois solvants permettant de réaliser les phases mobiles: butanol (le moins polaire), acide acétique
(à manipuler selon les règles de sécurité, gants, lunettes, hotte) et eau (le plus polaire).
- Le matériel pour réaliser les dépôts, une cuve pour les plaques de CCM, une étuve ...
Manipulations à réaliser
Utiliser 2 plaques CCM qui seront préparées à l'identique avec 6 dépôts: 5 acides aminés témoins à
sélectionner et du Sargenor.
Les deux migrations seront réalisées en utilisant des phases mobiles différentes. L'une d'elles devra être
le mélange butanol/acide acétique/eau 70v/20v/10v. L'autre la mélange butanol/acide acétique/eau
Fanny Demay – BTS BioAnalyses & Contrôles 3/5

30v/20v/50v (donc plus polaire) ou le mélange butanol/acide acétique/eau 90v/5v/5v (donc moins
polaire).
Mode opératoire pour réaliser les CCM demandées
Réactiver le gel de silice à l'étuve à 105°C pendant 30 minutes. Préparer une cuve de migration. Verser
au fond de la cuve le solvant de migration, jusqu'à ce que le niveau du liquide dans la cuve atteigne 8
mm de hauteur. Refermer la cuve et attendre 30 minutes, pour que l'atmosphère de la cuve soit saturée
(ceci a pour but de limiter l'évaporation de la phase mobile depuis la plaque).
Tracer, très légèrement au crayon graphite, une ligne de dépôt à 1,5 cm du bord inférieur de la plaque.
Marquer les emplacements des dépôts en les espaçant régulièrement et en veillant à laisser au moins 5
mm de chaque coté de la plaque
Pour déposer, utiliser des capillaires préparés par tirage de canne de verre ; on ne conserve que les
capillaires réguliers, de section nette, de diamètre convenable (essayer sur du papier filtre). Un capillaire
ne sert que pour déposer une seule solution. Ou alors, utiliser des pipettes mécaniques réglées à un
volume de 0,5 µL. Un dépôt ne doit pas excéder un diamètre de 3 mm (à cause de l'effet d'étalement
lors de la migration). Pour cette manipulation, a priori, effectuer les dépôts en 3 fois en séchant
soigneusement entre chaque opération à l'air chaud (sèche-cheveux).
Migration : plonger le bord inférieur de la plaque dans le solvant et laisser la migration s'effectuer jusqu'à
ce que le front du solvant soit à quelques mm du bord supérieur de la plaque.
En fin de migration, sortir la plaque, marquer immédiatement le front du solvant au crayon graphite.
Sécher la plaque au four. SOUS UNE HOTTE ASPIRANTE, pulvériser le réactif à la ninhydrine sur la
plaque en position légèrement inclinée, attendre 2 minutes et porter la plaque à l'étuve à 105°C pendant
3 à 4 minutes (il est aussi possible de passer le réactif de révélation au pinceau perpendiculairement à la
direction de migration).
Compte-Rendu :
Pour chaque manipulation réalisée :
- Composition exacte de la phase mobile utilisée ; plan des dépôts, mode opératoire exact de réalisation
des dépôts (en 1, 2, 3, 4 fois ...) ; résultats obtenus (entourer les spots révélés d'un léger trait de crayon
et fournir la plaque ou un calque du résultat. Calculer les Rf (rapport au front de migration) de chaque
tâche)
- Analyse critique. Peut on justifier a posteriori la migration différentielle des acides aminés témoins
testés lors de chaque manipulation (utiliser vos connaissances quant à la nature chimique des chaînes
latérales des acides aminés et éventuellement les données du document annexe)? Quelle phase mobile
est la plus performante? Peut on justifier les différences de migration obtenues par l'analyse de la
composition des 2 phases mobiles différente utilisées? Justification du choix des acides aminés témoins.
Que peut-on dire sur la composition en acides aminés du SARGENOR? Donner la réaction chimique de
révélation.
Document annexe :
Le document expose des résultats publiés par J. Kyte et R. Doolittle dans A simple method for displaying
thé hydropathic character of a protein ; Journal of molecular biology, mai 1982, 157 n°1, 105-132.
Les auteurs on établi une échelle d'hydropathie (hydrophilie ou hydrophobicité plus ou moins
marquée) des chaînes latérales R des aminoacides fondée sur la combinaison de 3 critères :
- un critère enthalpie libre. D'après des données pratiques et des calculs thermodynamiques, l'enthalpie
libre standard de transfert des différentes chaînes carbonées de formule RH depuis la phase solution
aqueuse vers la vapeur condensée est calculée (des valeurs négatives marquent l'hydrophobicité, des
valeurs positives l'hydrophilie) ;
- deux critères statistiques à partir d'une base de données de 12 structures conformationnelles
protéiques globulaires connues. Pour chacune des chaînes latérales des 20 acides aminés, il a été
calculé sa proportion dans la localisation à plus de 95% enfoui dans la structure ainsi que dans la
localisation à 100% enfoui. Plus une proportion est élevée plus l'acide aminé est statistiquement
hydrophobe.
Fanny Demay – BTS BioAnalyses & Contrôles 4/5

Les valeurs des différents critères ont été normalisées pour se distribuer chacune entre -4,5 et 4,5.
L'échelle finale obtenue résulte en principe de la moyenne pour chaque acide aminé des valeurs des
trois critères. Le tableau ci-dessous présente l'échelle finalement obtenue (l'échelle combinant les i
critères est dénommée hydropathy index).
[...
All values in the last 3 columns result from arbitrary normalisation to spread them between -4,5 and +4,5.
The normalization functions where :
a -0,679 ΔG°transfer en kcal/mol + 2,32.
b 48,1 (fraction 100% buried ; Chotia, 1976) – 4,50.
c 16,45 (fraction 95% buried ; Chotia, 1976) – 4,71
Fanny Demay – BTS BioAnalyses & Contrôles 5/5
1
/
5
100%