DOCX - 203.5 ko

Métabolisme cellulaire - 1
F. Brondex-E. Paitel
PARTIE 4. LA PHOTOSYNTHESE
Introduction :
Les végétaux verts n’ont pas besoin d’un apport de matière organique. Ils sont autotrophes pour le carbone et
autotrophes pour l’azote.
L’autotrophie pour le carbone est réalisée au niveau des chloroplastes : grâce au CO2 de l’air, la plante synthétise
des oses, puis toutes les autres catégories de molécules. L’énergie lumineuse est nécessaire pour réaliser ces
réactions, dites de photosynthèse. Il s’agit donc bien d’un métabolisme de photolithotrophie.
6 CO2 + 6 H2O C6H12O6 + 6O2
Réduction du CO2 en matière organique
Comment la plante collecte-t-elle de la lumière au niveau des chloroplastes ? Comment cette énergie lumineuse
est-elle convertie en énergie potentielle chimique sous forme de molécules organiques ? Quelles sont les
réactions permettant de passer du carbone minéral (CO2) au carbone organique (oses, aa…) ?
I. LA PHOTOSYNTHESE : OBSERVATIONS ET RESULTATS EXPERIMENTAUX
Les chloroplastes sont les organites de la photosynthèse, rappels
Les chloroplastes sont présents dans les cellules des feuilles (cellules du parenchyme lacuneux et palissadique i.e.
le mésophylle) mais aussi dans les cellules des tiges.
Les chloroplastes sont des organites à double membrane. Un réseau de mb interne forme les thylakoïdes. On
compte donc trois compartiments : espace intermembranaire, stroma et lumen des thylakoïdes.
Les mb externe et interne sont constituées d’environ 60% de lipides pour 40% de protéines. Les protéines des
membranes sont essentiellement des protéines transporteurs assurant les échanges entre le stroma et le cytosol.
Mais il semble que la mb externe soit plus perméable que la mb interne.
Le stroma contient une solution aqueuse, très concentrée, en particulier en protéines. On y trouve l’ADN du
chloroplaste (1 molécule circulaire), des ribosomes et les enzymes nécessaires à l’expression du génome du
chloroplaste. Le stroma contient aussi les enzymes nécessaires à la réduction – fixation du CO2, la plus connue
étant la Rubisco…
Les thylakoïdes sont constitués d’une membrane et forment un compartiment : le lumen. On distingue les
thylakoïdes granaires et intergranaires. Il existe une continuité entre thylacoïdes granaires et intergranaires
permettant la diffusion des molécules insérées dans la membrane. L'ensemble des lumens peut être considéré
comme un compartiment unique. La mb d’un thylakoïde contient approximativement : 40% de phospholipides,
10% de pigments et 50% de protéines. C’est le lieu de la collecte de la lumière. Parmi les protéines :
- les enzymes ATP synthase
- des protéines de transfert d’électrons (chaîne de transfert d’électrons)
- Complexes protéines pigments, les photosystèmes, qui captent les photons…
On remarque ici la relation structure fonction des thylakoïdes : leur structure plissée développe une grande
surface de collecte de la lumière, tout en étant maintenue dans un volume restreint.
La coupe de feuille permet de localiser les voies d’échanges :
- entrée du CO2 par les stomates et transit par le parenchyme lacuneux
- arrivée de l’eau par la sève brute et évaporation via les stomates
- Rejet de l’O2 par les stomates
La photosynthèse se déroule en deux phases : mise en évidence
1) Expérience de Hill
On travaille sur un isolat de thylakoïdes (extrait de chloroplastes, obtenus eux même à partir de feuilles,
protocole non détaillé). On mesure la concentration en O2 de l’enceinte grâce à une sonde oxymétrique.
Résultats
1- Dans un premier temps, les chloroplastes à la lumière ne dégage pas de O2 : les thylakoïdes semblent ne pas
fonctionner sans le reste du chloroplastes.
2- A t, on injecte le réactif de Hill qui est du ferricyanure de potassium, surtout un oxydant puissant (accepteur
d’électrons donc). A la suite de l’injection, seulement en présence de lumière, on observe un dégagement de O2.
Interprétation : au niveau de thylakoïdes, il se déroule une réaction d’oxydoréduction, qui conduit à la formation
de O2 : H2O serait oxydé en O2. Le réactif de Hill jouant le rôle de l’accepteur d’électrons (oxydant) : mais quel est
l’oxydant suffisamment fort pour oxyder l’eau ? En effet, le couple O2/H2O a un E°’ très élevé (O2 est un fort

Métabolisme cellulaire - 2
F. Brondex-E. Paitel
oxydant). De plus, la lumière est indispensable à la réalisation de cette réaction d’oxydoréduction : apporte-t-elle
l’énergie nécessaire à la réalisation de la réaction ?
2) Expérience de Ruben et Kamen (1940)
Une suspension de chlorelles (algues vertes unicellulaires) est fortement éclairée. L’eau de leur solution est
marquée radioactivement à l’oxygène 18 (H2 18O). Les chercheurs voulaient savoir ce que devient l’oxygène de
l’eau, d’après l’équation bilan, 2 possibilités :
- hypothèse 1 : l’oxygène se retrouve dans les molécules organiques
- hypothèse : l’oxygène se retrouve dans le dioxygène libéré.
Ils ont donc analyser le dioxygène libéré par les chlorelles : il contient du 18O en proportions voisines de celles de
l’eau.
Cette expérience permet de confirmer qu’il y oxydation de l’eau :
H20 ½ O2 + 2H+ + 2e-
Dans l’expérience de Hill, le réactif de Hill est l’accepteur des ces électrons et permet la réaction.
Mais il nous manque, l’autre demi réaction, quel est l’accepteur des électrons dans les chloroplastes ???
On parle de photo-oxydation de l’eau :
- Réaction d’oxydoréduction avec le couple O2/H2O (cf. Hill et Ruben & Kamen)
- la réaction nécessite de la lumière (cf. Hill)
- elle a lieu dans les thylakoïdes (cf. Hill)
- l’accepteur d’électrons est-il hors des thylakoïdes ?
3) Expérience de Gafron (1951)
On utilise encore une suspension de chlorelles très éclairée. On fait buller du CO2 mais avec le carbone marqué
(14C) afin de pouvoir mesurer la quantité de CO2 consommée au cours du temps. Les chlorelles subissent une
période d’éclairement pendant 1heure puis on les place à l’obscurité.
Résultats : l’incorporation de CO2 se prolonge quelques secondes (environ 20s) après le passage à l’obscurité.
Interprétation Les réactions d’incorporation du CO2 dans les molécules organiques ne nécessitent pas
directement la lumière puisqu’il y a qq secondes de latence.
Hypothèse : les réactions se déroulant à la lumière (« phase claire ») produisent des molécules utilisées lors de
réactions ne nécessitant pas la lumière (« phase sombre »).
Bilan :
6 CO2 + 6 H2O C6H12O6 + 6O2
Réduction du CO2 en ose (phase sombre)
Photooxydation de l’eau
II. LA PHASE DE PHOTO OXYDATION DE L’EAU
Les pigments photosynthétiques : des molécules capables d’absorber la lumière
1) Les pigments photosynthétiques : nature chimique
Comment extraire et séparer les pigments d’une feuille ? On peut réaliser une chromatographie sur papier pour
une étude simple et qualitative. Le solvant monte par capillarité dans le papier : les pigments sont entraînés,
d’autant plus qu’ils sont solubles dans le solvant. Il s’agit en fait des pigments présents dans les mb des
thylakoïdes. On retrouve :
- les caroténoïdes regroupant les carotènes et les xanthophylles. Ce sont des pigments dérivés isopréniques, ils
sont hydrophobes (et donc bien stables dans les mb). J’ai mis la formule du carotène, les xanthophylles ont une
formule très proche mais correspondent à une forme oxydée (cf. TP Electrophorèse chromatographie). On
remarque les doubles liaisons conjuguées : les électrons peuvent se délocaliser, ce qui est favorable à l’absorption
de lumière. Les caroténoïdes absorbent les longueurs d’onde entre 440 et 500nm (2 pics 440 et 480nm environ).
Ce qui correspond aux longueurs d’onde du bleu au vert, ils n’absorbent quasiment pas dans les longueurs d’onde
du rouge orange (vers 700nm), d’où leur couleur.
- les chlorophylles sont constituées d’un groupement tétrapyrolique (comme l’Hb ou les cytochromes) mais à
magnésium. Mais il faut noter une queue phytol, constituée d’une chaîne aliphatique carbonée (20C environ) très
hydrophobe qui stabilise la chlorophylle dans les membranes. On distingue la chlorophylle a et la chlorophylle b
qui diffèrent d’un groupement (méthyle et aldéhyde). Là aussi les électrons du groupement tétrapyrole peuvent
être délocalisés et absorber certaines longueurs d’onde. En l’occurrence, les chlorophylles ont deux pics

Métabolisme cellulaire - 3
F. Brondex-E. Paitel
d’absorption : entre 400 et 500nm (bleu), et vers 700nm (rouge). Elles n’absorbent pas le vert d’où leur couleur
(qui domine d’ailleurs).
Rq : spectre d’absorption = % de lumière absorbée pour chaque longueur d’onde
Spectre d’absorption, spectre d’action
On peut aussi construire des spectres d’action. En fait, on mesure l’activité photosynthétique, ici d’une algue
unicellulaire selon la longueur d’onde (on les expose à des lumières de longueur d’onde précise). L’activité
photosynthétique peut être mesurée par exemple par le rejet de dioxygène.
On mesure en parallèle le spectre d’absorption de l’algue (et non pas de pigments isolés).
Résultats et interprétation : on peut voir une remarquable coïncidence entre les longueurs d’onde absorbées et
l’intensité de la photosynthèse. Les 2 pics ressemblent un peu à ceux de la chlorophylle : un dans le bleu et un
dans le rouge. Mais ils sont plus larges : les autres pigments participent aussi à la photosynthèse.
2) Les pigments photosynthétiques : propriétés d’absorption de l’énergie lumineuse
La lumière peut être considérée comme :
- une onde électromagnétique. Comme toute onde, elle est caractérisée par une longueur d’onde (, homogène
à une distance, en nm), distance entre le sommet de 2 ondes. On peut aussi définir la fréquence (, mesurée en s-
1) : nombre de crêtes par seconde. Il existe une relation simple liant les deux paramètres : c= où c est la célérité
de la lumière, i.e. 300 000 km/s.
- un ensemble de particules : les photons. Chaque photon porte une certaine quantité d’énergie (1 quantum
d’énergie). La formule donnant la quantité d’énergie d’un quantum est : E=h=h.c/. avec h la constante de
Planck 6,63.10-34 J.s)
« Sunlight is like a rain of photons of different frequencies ». La lumière du soleil est constituée de photons de
fréquences variées, situées dans le visible ou non (UV…). Lorsqu’un pigment reçoit un photon, il absorbe une
énergie (selon la formule de Planck) : plus la longueur d’onde est élevée, plus l’énergie reçu est faible (et
inversement). Le pigment passe de son état d’énergie bas (et stable) vers un état dit excité, de plus haute énergie
(instable).
Chl + h Chl* Chl* notation pour l’état de transition de haute énergie, instable.
Plus précisément, un électron change de niveau énergétique. Il existe alors 4 façons possibles de restituer
l’énergie absorbée :
- par émission de chaleur (énergie thermique, perdue)
- par émission d’un photon de plus basse énergie (c’est-à-dire de plus grande longueur d’onde). C’est le
phénomène de fluorescence.
- Par transfert d’excitation par résonance : un pigment transmet son énergie directement à un autre
pigment voisin, qui passe à son tour à l’état excité (électron passant à un plus niveau énergétique). Il n’y a
donc pas d’émission de photon. Il faut pour cela que les pigments soient très proches. Il faut aussi que les
niveaux d’énergie de l’état excité soient équivalents.
- Par transfert d’un électron. L’énergie reçue provoque une diminution du potentiel redox et un électron
peut être cédé à un accepteur. L’électron passé à l’état de plus haute énergie, est cédé plus facilement…
Mais comment ces pigments sont-ils organisés dans la membrane du thylakoïde ? Comment captent-ils l’énergie
lumineuse ?
Les photosystèmes, les structures de collecte de la lumière génèrent un gradient de
protons et du pouvoir réducteur
1) Les photosystèmes collectent la lumière…
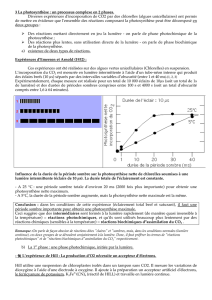
Emerson, dans les années 1950, a réalisé des mesures de l’efficacité de la photosynthèse. Il utilise le rendement
quantique comme paramètre d’estimation de l’efficacité.
Rdt quantique = (quantité d’O2 produit)/(nb de photons absorbés)
Emerson a mesuré le rendement quantique obtenu avec différentes longueurs d’onde (sur des chloroplastes), en
particulier 680 et 700nm
Résultat : le rendement quantique obtenu avec le mélange (680nm + 700nm) est supérieur à la somme des
rendements quantiques obtenus avec 680nm ou 700nm. Rdt(680+700)>rdt(600)+rdt(700)
Interprétation : il existe deux structures de collecte de la lumière, l’une absorbant préférentiellement vers 680nm
l’autre vers 700nm. Mais elles fonctionnent en synergie, elles sont complémentaires l’une de l’autre : le rdt
quantique est beaucoup plus élevé, lorsqu’elles fonctionnent toutes les deux.

Métabolisme cellulaire - 4
F. Brondex-E. Paitel
On les appelle les photosystèmes : il y a le photosystème II, qui absorbe à 680nm et le photosystème I, qui
absorbe à 700nm.
Organisation et principe du fonctionnement d’un photosystème
Un photosystème est un complexe protéines/pigments (caroténoïdes, chlorophylles…) inséré dans la membrane
des thylakoïdes. On distingue :
- une antenne collectrice qui reçoit l’énergie lumineuse, l’énergie y est transmise de pigment à pigment par
résonance (transfert d’excitation par résonance). Pour que le transfert d’énergie par résonance se fasse il faut (1)
que les pigments soient très proches, ce qui est le cas dans un photosystème. (2) Il faut aussi que les niveaux
d’énergie de l’état excité soient équivalents. Un peu d’énergie est perdue à chaque transfert.
- un centre réactionnel, il est constitué d’une (ou 2) chlorophylle a qui est le dernier accepteur d’énergie.
L’énergie reçue provoque une diminution du potentiel redox et un électron peut être cédé à un accepteur. La
chlorophylle a du centre réactionnel, lorsqu’elle passe dans son état excité, a un potentiel redox abaissé, elle peut
céder un électron (à un plus fort oxydant)
Finalement, la réaction réalisée est la suivante, normalement non spontanée :
Dréd + Aox Dox + Ared
2) … apportant l’énergie pour un transfert d’électrons
On a vu qu’il existe deux photosystèmes :
- le photosystème II ou P680 absorbe à 680nm. Il est majoritairement situé au niveau des thylakoïdes
granaires.
- Le photosystème I ou P700 absorbe à 700nm. Il est majoritairement situé au niveau des thylakoïdes
intergranaires, en contact avec le stroma.
Le photosystème II permet l’oxydation de l’eau, il agit donc comme un oxydant très puissant (plus fort que O2 lui-
même un oxydant très fort). Il comprend :
- l’antenne collectrice transmembranaire avec des chlorophylles a, b, des carotènes associés à un complexe
protéique.
- le centre réactionnel transmembranaire est formé de 2 protéines, d’un dimère de chlorophylles a, de
phéophytine des quinone A et B. Lorsque la chl a est excitée, son potentiel redox chute, elle peut céder un
électron à la phéophytine (Accepteur d’électons). Elle passe à l’état oxydé chla+ (l’état excité étant instable, elle
revient à l’état de bas)
chla* chla+* + e- chla+* redevient instantanément chla+
phéophytine ox + e- phéophytine réd
- un centre de Mn, lieu précis de l’oxydation de l’eau, situé côté lumen.
La ½ réaction est :
2H2O O2 + 4H+ +4e-
La production de 1 O2 libère 4 électrons, le centre de Mn a un fonctionnement cyclique à 5 états permettant de
libérer les électrons 1 par 1. Et d’éviter par conséquent la formation d’intermédiaires toxiques. Le donneur
d’électrons qui régénère la chla à partir de chla+ est donc ici l’eau via le centre de Mn.
Remarque : le photosystème II est localisé majoritairement au niveau des thylakoïdes granaires.
La phéophytine peut céder ses électrons à la quinone A (QA), qui les cède immédiatement à la quinone B (QB).
Enfin c’est la plastoquinone (PQ) qui reçoit 2 électrons et 2 protons, elle passe à l’état réduit (PQH2). A l’état
-
Forts
réducteurs
+
0
Forts
oxydants
Chla+/chla
Chla+/chla*
Aox/Ared
lumière
Dox/Dred

Métabolisme cellulaire - 5
F. Brondex-E. Paitel
réduit, elle peut se dissocier du complexe et elle devient mobile dans la membrane. Elle emporte ainsi les
électrons vers le complexe b6f.
Remarque : la plastoquinone a une structure proche de la quinone mitochondriale, en particulier une queue
hydrophobe les stabilise dans la membrane.
Le complexe b6f reçoit les électrons. Il s’agit d’un complexe protéique à 4 sous unités, avec plusieurs
groupements prosthétiques : 2 hèmes de type c, 1 hème de type f, un groupement fer soufre. La structure et le
fonctionnement ressemblent un peu à ceux du cytochrome c réductase.
La plastoquinone (QH2) cède 1 électron au groupement FeS. FeS transmet à l’hème c. Cyt c cède à la
plastocyanine qui est un transporteur mobile. Au niveau du complexe b6f, les transferts d’électrons se font dans
le sens des potentiels croissants, donc spontanément. L’énergie libérée par les réactions d’oxydoréductions est
convertie en un gradient de protons. Le complexe b6f fonctionne comme une pompe à protons (vers le lumen).
La plastocyanine est une petite protéine avec un atome de Cu (Cu3+/Cu2+). Il s’agit d’une protéine majoritairement
hydrophile, elle est dissoute côté lumen mais elle reste en contact avec la membrane thylakoïdienne. Elle cède
ses électrons au complexe P700, le photosystème I.
Le photosystème I est à l’état excité un très fort réducteur, il permet la formation de NADPH,H+.
- L'antenne collectrice renferme des molécules de chorophylles a, de chlorophylles b et des caroténoïdes. Et des
protéines…
- Le centre réactionnel contient un dimère de chlorophylles a piège (P700), une molécule (A) spécialisée dans la
capture de l'électron du P700 ainsi que différents centres fer-soufre, qui jouent le rôle de transporteurs
d'électrons jusqu'à l'accepteur final du PSI constitué par la ferredoxine (Fd).
Remarque : le PSI est lui situé majoritairement au niveau des thylakoïdes intergranaires. Ce qui permet un accès
aux molécules du stroma impliquées dans les réactions (NADP+/NADPH,H+)
La ferredoxine est une petite protéine plutôt hydrophile, située sur la face stroma de la membrane. Elle cède ses
électrons à l’accepteur final, un NADP+. La réduction du NADP+ en NADPH,H+ se fait au niveau d’un complexe
enzymatique ferredoxine NADP réductase.
Bilan :
2 H2O O2 + 4H+ +4e- E°’=0,82V
2 NADP+ + 4H+ +4e- 2 NADPH,H+ E°’=-0,32V
2 H2O + 2 NADP+ O2 + 2 NADPH,H+ ΔrG°’=+104kcal/mol = +437kJ/mol
La réaction globale est endergonique, très endergonique. Un apport d’énergie extérieur est nécessaire : c’est
l’énergie lumineuse.
QH2
Q
FeS ox
FeS red
Hème c ox
Hème c red
Plastocyanine ox
Plastocyanine red
Hèmes b
Q°
Fonctionnement du complexe b6f
P700*
P700+
P700
h
A0 ox
A0 red
PCred
PC ox
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%