epreuve commune

EPREUVE COMMUNE DE SECONDE DUREE 1H
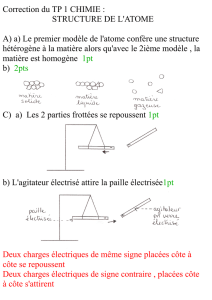
PARTIE I : L’atome , les ions.
EXERCICE I
Le noyau d’un atome d’Aluminium est caractérisé par les nombres A=27 et Z=13
(1pt ) 1/ Donner le symbole du noyau de l’atome d’aluminium
(1pt ) 2/ Donner les noms de A et Z.
(1pt ) 3/ Déterminer le nombre de protons du noyau.
(1pt ) 4/ Déterminer le nombre de neutrons du noyau.
(1pt ) 5/ Combien d’électrons possède cet atome ?
(1pt ) 6/ Calculer la masse approchée d’un atome d’aluminium.
(1pt ) 7/ Donner la structure électronique d’un atome d’aluminium.
Données : mneutron = mproton= 1,67.10-27kg mélectron= 9,1.10-31kg
EXERCICE II
Le noyau d’un atome a une charge Q= 5.10-19C et contient 6 neutrons.
(1pt ) 1/ Calculer le nombre de protons de son noyau.
(1pt ) 2/ En déduire le nombre de nucléons du noyau.
(1pt ) 3/ Donner le symbole de cet atome , en vous aidant de la classification périodique fournie en annexe.
Charge d’un électron qé=1,6.10-19C
EXERCICE III
Soit les noyaux caractérisés par les couples de valeur (Z ;A) suivants :
(6 ;12) (16 ;32) (16 ;33) (6 ;13) (16 ;36)
(6 ;14)
(1pt ) 1/ Un élément chimique est il caractérisé par la valeur de Z ou par la valeur de A ?
(1pt ) 2/ En déduire le nombre d’éléments chimiques représentés.
(1pt ) 3/ Donner la définition d’un isotope.
(1pt ) 3/ Identifier les isotopes et donner leur nom en vous servant de la classification périodique.
EXERCICE IV
On donne le numéro atomique des atomes suivants :
a. Oxygène O Z=8
b. Argon Ar Z=18
c. Magnésium Mg Z= 12
Pour chaque atome :
(3pt ) 1/ Déterminer le nombre d’électrons
Etablir la formule électronique de l’atome
Déterminer le nombre d’électrons situés sur la couche externe.
(2pt ) 2/ Même questions pour les ions O2- et Mg2+
PARTIE II : Les spectres
EXERCICE I
L’année de lumière : 4 pts
1) Donner la valeur approchée de la vitesse de la lumière dans le vide (celle que l’on utilise dans les calculs).
1pt
2) Donner la définition de l’année de lumière. 1pt

Le 23 février 1999, les astronomes ont observé l’explosion de l’étoile « MA 2384 » dans la nébuleuse
d’Orion située à 7,5.1019km de la Terre.
3) A quelle distance, en année de lumière, se trouve cette étoile ? 1pt
4) En quelle année s’est produite cette explosion ? 1pt
Donnée : 1A.L = 9,5.1012 km
EXERCICE II : Les spectres : 6 pts
On donne Les limites des longueurs d’ondes (en nm) des couleurs du spectre d’une lumière blanche et les
longueurs d’ondes (en nm) de quelques raies émises par différents éléments chimiques à l’état gazeux :
Violet
Bleu
Vert
Jaune
Orange
Rouge
400-424
424 – 491
491-575
575-585
585-647
647-700
Limites des longueurs d’ondes des couleurs du spectre d’une lumière blanche
Nom
Symbole chimique
Longueurs d’ondes
Hydrogène
H
397 ; 410 ; 434 ; 486 ; 656 ;
Hélium
He
447 ; 471 ; 492 ; 501 ; 587 ; 668
Mercure
Hg
432 ; 547 ; 575 ; 580 ; 670 ; 690
Néon
Ne
439 ; 443 ; 585 ; 597 ; 618 ; 640
Longueurs d’ondes (en nm) de quelques raies émises par différents éléments chimiques
1) Quel système dispersif permet d’obtenir le spectre d’une lumière colorée ? 1pt
L’étiquette indiquant la nature du gaz contenue dans une ampoule a été
effacée par l’usure.
La nature du gaz était représentée par son symbole chimique qui est
partiellement affiché (voir l’étiquette ci-contre).
Le spectre observé sur l’écran a permis d’obtenir la figure suivante :
2) Le spectre obtenu est-il un spectre continu ? sinon comment le nommé ? 1,5pt
3) Les raies du spectre sont numérotées de 1 à 7.
Donner les longueurs d’ondes des différentes raies du spectre puis indiquer la couleur de chacune.2pts
Raie n°
1
2
3
4
5
6
7
(nm)
4) En déduire la nature du gaz enfermé dans l’ampoule. 1,5pt
I Légender un schéma :
H
(nm)
1 2 3 4 5 6 7

Le schéma ci contre représente le phénomène de réfraction d’un faisceau lumineux.
1)Identifier sur le schéma à l’aide de flèches :
a) Le point d’incidence
b) Le dioptre
c) La normale
d) L’angle d’incidence
e) L’angle réfracté
f) Le milieu d’indice de réfraction n1
g) Le milieu d’indice de réfraction n2
h) Orientez correctement les 2 angles i1 et i2
2) ENONCEZ LES 2 LOIS DE SNELL-DESCARTES POUR LA REFRACTION en utilisant, au besoin , les
notations précédentes.
III IDENTIFIER UN MATERIAU AVEC LA LUMIERE
Un élève prend un disque optique dans l’armoire de physique mais un doute l’envahit, en effet tous les
disques optiques ont été mélangés
Il sait qu’il n’y avait que des disques en flint et en verre. Il cherche donc à déterminer la nature du matériau
qui constitue ce disque et décide de mesurer son indice de réfraction n .
Il fait donc passer un rayon monochromatique, d’abord dans l’air puis dans le matériau et mesure les angles
d’incidence et de réfraction qui valent respectivement 30° et 14.5 ° .
Il détermine enfin l’indice de réfraction du matériau et le compare aux 2 valeurs qu’il connait

n flint= 2 n verre= 1.5. On donne l’indice de l’air n air = 1
1) utilisez les résultats de l’élève pour déterminer à votre tour la nature du matériau. Vous détaillerez vos
résultats
2) pourquoi a t il choisi de prendre de la lumière monochromatique ?
III QUELQUES QUESTIONS :
1) Citez un système dispersif
2) Que veut dire l’expression : disperser la lumière ?
3) Puis-je disperser la lumière monochromatique ? Pourquoi ?
4) Dans un arc- en- ciel qu’est ce qui disperse la lumière du soleil ?

Annexe
Z
Z
 6
6
1
/
6
100%