TP n°19 : Utilisation du prototype de spectrophotomètre

TP n°19 : Utilisation du prototype de spectrophotomètre.
Objectif : utiliser le prototype du spectrophotomètre réalisé au TP précédent pour doser une solution S de
sulfate de cuivre.
1. Dosage par étalonnage d’une solution.
a) A quelle longueur d’onde pouvez-vous travailler ? Justifier alors le choix de la solution.
b) Vous disposez d’une solution S0 de sulfate de cuivre de concentration massique 16 g.L-1. Préparer par
dilution de cette solution des solutions étalons en suivant le tableau ci-dessous.
n° de la solution
S1
S2
S3
S4
S5
Volume de solution S0 utilisé
Vi (mL)
20
15
10
5
2,5
Masse de sulfate de cuivre
présente dans ce volume (g)
Concentration de la solution
obtenue (g.L-1)
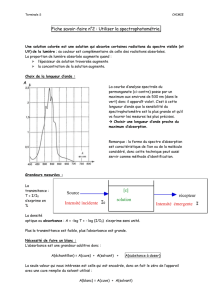
c) Réaliser le montage ci-dessous :
Veillez à faire arriver le faisceau laser au centre de la photodiode, la tension UR est alors maximale (noter
URMAX = ……..).Entre chaque mesure, vous veillerez à toujours retrouver cette valeur de la tension.
d) « Faire le blanc » en plaçant dans le boîtier une cuve d’eau distillée. Relever la tension UR0.
e) Dans Synchronie, créer un tableau avec les variables concentration et UR.
f) Placer successivement les solutions étalons dans le boîtier et relever la tension UR pour chacune d’elle.
Compléter le tableau dans Synchronie.
g) Utiliser la feuille de calcul de Synchronie, pour calculer le rapport
RO
R
U
U
pour chaque solution étalon.
h) Quitter le tableur et régler les paramètres pour obtenir la courbe d’étalonnage
RO
R
U
U
=f( c ).
i) Mesurer UR pour la solution S. En déduire sa concentration.
j) Votre prototype est-il satisfaisant ? Vous permet-il de faire une travail analogue à celui du
spectrophotomètre utilisé en classe ? Quelles sont ses limites ?
Diode laser
Boîtier avec
photodiode
UR
-
+
6 V

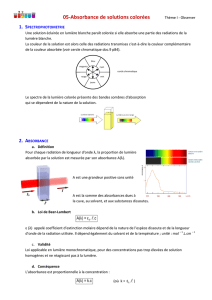
2. Définition de l’absorbance.
a) Comparer l’allure de la courbe d’étalonnage obtenue avec l’allure des courbes A=f(c) rencontrée dans les TP
précédents. Quelle courbe vous semble plus facile à utiliser ?
b) On propose de définir une nouvelle grandeur, appelée B, que l’on peut calculer grâce à la formule :
B= - log
0R
R
U
U
. « log » signifie « logarithme », c’est une fonction mathématique que l’on, ne cherchera pas
à étudier.
Créer la variable B dans votre tableau de Synchronie.
A l’aide de la feuille de calcul, calculer la valeur de B pour chaque solution étalon.
c) Quitter le tableur et régler les paramètres pour tracer le graphique B=f(c).
d) Quelle est l’intérêt de la variable B par rapport à
RO
R
U
U
?
e) Que pouvez-vous en déduire sur la définition de la grandeur absorbance ?
3. Loi de Beer-Lambert.
Enoncé :
A= kc où A est l’absorbance
c est la concentration
k est un coefficient qui dépend de la solution étudiée, de la longueur d’onde et de l’épaisseur de la
cuve.
Cette loi a-t-elle été vérifiée par toutes les solutions étudiées au cours des TP de spectrophotométrie ?
Application :
On dispose d’une solution S0 de sulfate de nickel de concentration massique c0=0,36 mg.L-1. A partir de celle-
ci, on prépare plusieurs solutions étalons en versant un volume Vi de solution S0 dans une fiole jaugée de 50 mL
que l’on complète avec de l’eau distillée.
a) Calculer la concentration massique des différentes solutions, le volume Vi étant indiqué dans le tableau
ci-dessous.
Nom de la solution
S1
S2
S3
S4
S5
Volume de solution S0
utilisé Vi (mL)
25
20
15
10
5
On mesure l’absorbance à = 720 nm des différentes solutions étalons :
Nom de la solution
S1
S2
S3
S4
S5
A
0,217
0,415
0,640
0,855
1,100
b) Sachant que les solutions les solutions de sulfate de Nickel sont vertes, justifier le choix de la longueur
d’onde.
c) La loi de Beer-Lambert est-elle vérifiée pour cette gamme étalon. Déterminer le coefficient de
proportionnalité k.
d) L’absorbance d’une solution de sulfate de nickel est A=0,720. Quelle est la concentration de cette
solution ?
1
/
2
100%