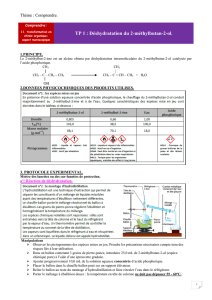
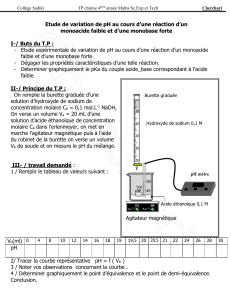
Vérification de l`exactitude et de la précision d`appareils

Laboratoire No.1 Chimie générale 202-NYA
1-
1
Collège Montmorency
Rédacteur :
Coéquipièr(e) :
Groupe :
Professeur :
Rapport de Laboratoire No.
PRÉCISION ET EXACTITUDE DES APPAREILS VOLUMÉTRIQUES
Note du rédacteur
Maximum
Présentation
Tableaux de données
Tableaux de résultats
Calculs
Conclusion
Total
Note des 2 équipiers
Maximum
Précision et Exactitude
10
Date d’exécution du laboratoire

Laboratoire No.1 Chimie générale 202-NYA
1-
2
VERIFICATION DE L'EXACTITUDE ET DE LA PRECISION D'APPAREILS
VOLUMETRIQUES GRACE A L'UTILISATION D'UNE BALANCE ANALYTIQUE
Introduction
Les appareils volumétriques servent à mesurer des volumes de liquide. Pour pouvoir étalonner ces
appareils volumétriques ( c'est-à-dire vérifier l'exactitude des valeurs obtenues avec ces appareils ) il faut
disposer d'un meilleur instrument qui permette de déterminer les mêmes volumes avec plus de précision
que l'appareil qu'on veut étalonner.
Pendant ce laboratoire on aura à vérifier si la balance analytique est un instrument adéquat pour
étalonner les appareils volumétriques suivants : un distributeur de 25 mL, une burette de 25 mL et un cy-
lindre gradué de 100 mL. Si la balance peut jouer ce rôle, on pourra alors vérifier l'exactitude de ces appa-
reils volumétriques.
En effectuant plusieurs mesures avec les appareils volumétriques on pourra aussi vérifier la préci-
sion des mesures effectuées avec ces appareils.
On utilisera donc un appareil volumétrique pour transférer un certain volume d'eau ( V mL ) dans un
erlenmeyer et on utilisera une balance analytique pour mesurer la masse apparente ( Ma ) de cette eau.
La masse mesurée est dite "apparente" car l'eau est pesée dans l'air ambiant. Cet air, comme tout fluide,
exerce une poussée verticale ascendante égale au poids de l'air déplacé. On nomme cette force poussée
d'Archimède ( PA ), selon le philosophe et scientifique grec qui l'a découvert. La poussée d'Archimède est
la force qui, par exemple, fait monter les ballons dirigeables et maintient à flot les navires.
Dans l'expérience réalisée, la poussée d'Archimède sera donnée par :
PA = V x air
PA = Poussée d’Archimède (g)
V = Volume d’air déplacé par l’eau ou volume de l’eau ( L )
air = Masse volumique de l’air aux conditions de température et de pression de l’expérience ( g/L )
L'Annexe III du cahier de laboratoire donne des valeurs de air. On prendra la valeur qui correspond
le mieux aux conditions de température et de pression du laboratoire.
La masse réelle de l'eau (Mr) est celle qu'on obtiendrait s'il n'y avait pas d'air pour exercer la pous-
sée vers le haut. Elle est donc donnée par :
Mr = Ma + PA
Mr = Masse réelle de l’eau (g)
Ma = Masse apparente de l’eau (g)
PA = Poussée d’Archimède (g)
A partir de la masse réelle de l'eau on peut calculer son volume ( Vc ) en utilisant la masse volu-
mique de l'eau ( eau ). L'Annexe II du cahier de laboratoire donne des valeurs de eau.
Vc = Mr / eau
Vc = Volume d’eau calculé (mL)
Mr = Masse réelle de l’eau (g)
eau = Masse volumique de l’eau (g/mL)

Laboratoire No.1 Chimie générale 202-NYA
1-
3
Notons que Vc est le volume de l'eau tel que calculé à partir des mesures sur la balance.
L’incertitude sur ce volume, Vc, est la limite de précision avec laquelle on peut mesurer un volume de
liquide à l’aide de la balance analytique.
Soit V le volume de l’eau tel qu’indiqué par l’appareil volumétrique et V, l’incertitude liée à la
lecture d’un volume de liquide contenu dans un appareil volumétrique. Cette incertitude vient de la difficul-
té de bien identifier la position du ménisque par rapport aux graduations de l’appareil. Les valeurs des V
des appareils utilisés sont dans l’annexe I.
Si Vc < V pour un instrument donné, on pourra considérer la balance comme étant plus
précise que l'appareil volumétrique. On pourra alors utiliser la balance pour étalonner l'appareil volu-
métrique, c'est-à-dire qu'on pourra utiliser les volumes calculés avec la balance ( Vc ) pour corriger les
résultats obtenus avec les appareils volumétriques ( V ).
Buts
1. Vérifier qu'il est fondé d'utiliser une balance analytique pour étalonner divers instruments volumé-
triques : distributeur de 25 mL, burette de 25 mL, cylindre gradué de 100 mL.
2. Vérifier la précision des résultats obtenus avec les appareils volumétriques mentionnés.
3. Vérifier l'exactitude des résultats obtenus avec les appareils volumétriques mentionnés.
Théorie
A partir des données recueillies au laboratoire, l’ordinateur du laboratoire calculera les valeurs de Vc
et de Vc pour chacun des essais effectués. Ces calculs sont les mêmes qu’au prélab de la page 1-1 et
n’auront donc pas à être refait dans le rapport de laboratoire.
Vc = Volume d'eau délivré par un appareil volumétrique donné, tel que calculé à partir de la masse
de l'eau
Vc = Incertitude théorique sur Vc
V = Incertitudes des instruments ( Annexe I )
Précision des résultats
Pour un appareil donné, la comparaison de emax et V l'écart maximum à la moyenne et l’incertitude
de l’instrument permet de dire si les résultats obtenus sont précis.
emax = | Vc(valeur moyenne) - Vc(valeur extrême) |
On aura un résultat précis si
emax < 2 x V
Si non. Le résultat est imprécis.
Lorsque la valeur de et max sont connus, on présente et on arrondit la valeur moyenne avec le
plus grand des deux.

Laboratoire No.1 Chimie générale 202-NYA
1-
4
Exactitude des résultats
Seulement pour un appareil qui a été utilisé avec précision, la comparaison de | E | et V , la
valeur absolue de l'erreur et l’incertitude de l’instrument permet de dire si les résultats obtenus sont
exacts.
E = Vc( valeur moyenne ) - 25,000 mL
On aura un résultat exact si
1er Si le résultat est précis, ( sans quoi on ne peut conclure quant à l’exactitude ) et
2ème si | E | < 2 x V alors le résultat est exact.
Si la seconde condition n’est pas vérifiée, le résultat est inexact.

Laboratoire No.1 Chimie générale 202-NYA
1-
5
Mode opératoire
ATTENTION ! UNE BALANCE ANALYTIQUE EST UN INSTRUMENT DELICAT QUI EXIGE D'ETRE
MANIPULE AVEC SOIN. GARDEZ LE PLATEAU DE LA BALANCE PROPRE EN TOUT TEMPS. N'UTILISEZ PAS
LA BALANCE AVANT D'AVOIR REÇU LES INSTRUCTIONS NECESSAIRES. VERIFIEZ L'AJUSTEMENT DU
ZERO. UTILISEZ LA MEME BALANCE POUR TOUTES VOS MESURES.
1. Nettoyez un cylindre gradué de 100 mL et une burette de 25 mL. Rincez plusieurs fois à l'eau distil-
lée.
2. Lavez et essuyez soigneusement l'extérieur d'un erlenmeyer de 125 mL. MANIPULEZ DORENAVANT
L'ERLENMEYER AVEC DES PINCES ET NE LE DEPOSEZ QUE SUR UNE FEUILLE DE PAPIER PROPRE.
Rendez-vous à la salle des balances avec l'erlenmeyer, votre feuille de données et un crayon. Pe-
sez l'erlenmeyer vide et notez sa masse.
? Pourquoi ne laver et essuyer que l’extérieur de l’erlenmeyer ?
3. Remplissez la burette avec de l'eau distillée et ajustez soigneusement le ménisque à zéro (VOIR LA
SECTION TECHNIQUE DE TRAVAIL OU L'ANNEXE VII). Transférez 25,00 mL d'eau de la burette à
l'erlenmeyer (FERMEZ LA BURETTE QUAND L'EAU EST RENDUE A LA MARQUE DES 25 ML). Notez la
masse de l'erlenmeyer.
4. Transférez 25,0 mL d'eau du distributeur à l'erlenmeyer précédent. Notez la masse de l'er-
lenmeyer.
5. Transférez 25,0 mL d'eau du cylindre gradué à l'erlenmeyer précédent. Notez la masse de l'er-
lenmeyer.
6. Notez la température de l'eau dans l'erlenmeyer, la température de l'air et la pression atmos-
phérique.
7. Videz l'erlenmeyer et reprenez les opérations 2 à 6 pour un deuxième essai.
? Est-il nécessaire d’essuyer l’intérieur de l’erlenmeyer après l’avoir vidé?
8. Complétez le tableau de données ( dernière page du rapport de laboratoire ). Saisir les données
dans l'ordinateur et notez les résultats calculés par l'ordinateur ( sans oublier Vc ).
9. Remettre une copie du tableau de données avant de quitter le laboratoire.
10. Rincez et rangez votre matériel avant de quitter le laboratoire.
 6
6
 7
7
 8
8
 9
9
 10
10
1
/
10
100%