Etude de la réaction chimique (TP)

Etude d’une réaction chimique (TP)
I-Objectifs :
-Identifier une espèce chimique par un test de précipitation.
-Calculer des quantités de matière.
-Identifier expérimentalement le réactif en défaut, le réactif en excès, ou si le mélange des
réactifs est dans les proportions stœchiométriques.
-Relation entre quantités de matière pour un mélange dans les proportions stœchiométriques
ou non.
-Etablir un bilan de matière suivant le mélange initial préparé.
II- Présentation qualitative de la réaction étudiée (voir schéma ci-dessous):
Verser un peu de poudre de sulfate de cuivre pentahydraté (bleu) dans un bécher. Ajouter
un peu d’eau. Agiter pour dissoudre le produit. Ajouter quelques gouttes d’une solution
d’hydroxyde de sodium (ou soude) et observer.
Questionnaire1 :
-Comment appelle-t-on ce type de réaction ? Quelle espèce chimique permet-elle
d’identifier.
-Sachant que le produit formé est de l’hydroxyde de cuivre (II), de formule Cu(OH)2,
écrire l’équation bilan équilibrée de la réaction en indiquant uniquement les espèces
chimiques qui se transforment.
Réponses
III-Etude quantitative de la réaction :
La question que l’on se pose est celle de tout chimiste étudiant une réaction. Quelles quantités
de réactifs faut-il mélanger pour obtenir une quantité choisie à l’avance de produit tout en
évitant de gaspiller inutilement des réactifs?

Questionnaire2 : (répondre en s’aidant si besoin de la calculette)
-Quelle est l’unité appropriée pour mesurer les quantités de matière en chimie?
-Calculer la quantité de matière de sulfate de cuivre pentahydraté (CuSO4, 5 H2O) qui
correspond à une masse de 1,0 grammes ?
(On donne en g.mol-1 MCu=63,5 ; MS=32,0 ; MO=16,0 ; MH=1,0 )
-Quelle grandeur associée a la solution d’hydroxyde de sodium est-il indispensable de
connaître pour faire une étude quantitative de la réaction ? Définir cette grandeur.
-Sachant que la solution d’hydroxyde de sodium contient 1,6 moles par litre, calculer la
quantité de matière présente dans un volume V=1,0cm3 de cette solution.
Réponses
Description de l’expérience quantitative :
Partager la classe en 8 groupes de travail. Chaque groupe devra réaliser les opérations
suivantes:
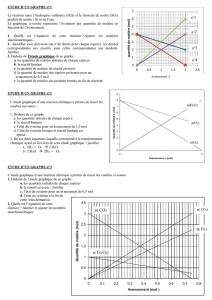
Lire le texte et observer les schémas ci-dessous
1-Poser un bécher sur une balance, faire le zéro, puis peser m=1,0 g de sulfate de cuivre
pentahydraté dans le bécher (fig1).

2-Ajouter environ 50mL d’eau et agiter (fig 2).
3-Remplir une burette de solution de soude de concentration c=1,6mol.L-1.(fig3)
Verser V(mL) de soude, noter la valeur de V suivant le groupe (l’inclure dans le tableau ci-
dessous) :
Groupe 1 : V=1,0cm3 ; groupe 2 : V=2,0cm3….etc
Après avoir versé les V(mL) de soude, bien agiter le contenu du bécher afin que toutes les
espèces réactives mélangées participent à la réaction.
4-Filtrer la solution
Introduire un filtre dans un entonnoir. Poser ce dernier sur un tube essais. Faire couler
doucement en agitant le contenu du bécher.
Chaque groupe pose ensuite son tube sur un support visible par tout le monde.
Comparer les couleurs des différents filtrats obtenus par les différents groupes (fig.ci-
dessous).
Questionnaire n°3 :
-Quel est le but de la filtration ?
-Que contiennent les filtrats ?
-Pourquoi les filtrats des groupes 1 à 4 sont-ils bleus ?
-Justifier la progression de la couleur bleue de 1 à 4 ?
-Les tubes 5 à 8 sont incolores, que peut-on conclure pour la réaction réalisée par les
groupes correspondants ? En particulier pour le mélange 8 ? Proposer un test pour le
vérifier.
Verser une goutte de solution de sulfate de cuivre dans chacun des tubes : 8, 7, 6 puis 5.
Observer et conclure.
-Indiquer le réactif en excès et le réactif en défaut pour chaque mélange (colonne 5).
Quelle particularité présente les quantités mélangées par le groupe 5 ?
Réponses
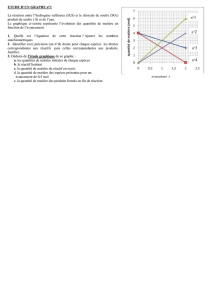
Questionnaire n°4 :
(Les résultats sont à inclure dans le tableau ci-dessous)
N° du
groupe
ou
mélange
Volume
de NaOH
V(mL)
Quantité n1 pesée
de Cu2+ (mol)
Quantité n2 versée de
NaOH(mol) avec
burette
Indiquer
le réactif en excés ;
le réactif en défaut
1
1,0
2
2,0

3
3,0
4
4,0
5
5,0
6
6,0
7
7,0
8
8,0
-Calculer les quantités de matière mélangées de Cu2+ et d’OH- (colonnes 3 et 4 du
tableau).
-Quelles proportions de réactifs semblent les mieux adaptées ? Pourquoi ?
-Pour le mélange 5, indiquer la relation d’égalité entre les quantités de matière de
réactifs (compléter l’écriture ci-dessous).
initiale
HO
initialeCu n
n
triquesstoechiomésproportionlesdansinitialmélange
2
.
Cette relation est-elle en accord avec l’équation de la réaction ?
Pour les autres mélanges, transformer la relation précédente en inégalité.
Correction
IV Bilans de matière :
Quelle quantité de produit pourra-t-on obtenir ?
-Si le mélange est dans les proportions stœchiométriques :
-Si le sulfate de cuivre est en excés ( soude en défaut) :.
-Si la soude est en excés (sulfate de cuivre en défaut) :
Règles : la quantité de produit formé est toujours dépendante de la quantité de
réactif en défaut.
Le réactif en défaut disparaît complétement
Compléter les tableaux ci-dessous :
Mélange n°1
Cu2+ + …OH-
Cu(OH)2
Etat initial
(avant réaction)
(1)n1initiale………mol n2initiale……….mol
Relation entre quantités initiales:
initialeinitiale nn 21
0

………………..en défaut
Quantités de
réactifs qui
disparaissent
dispdisp nn 21
(2)n1disp ………mol n2disp…………mol
Etat final
(après réaction)
(1)-(2)
n1final………….mol n2final=……. … mol
dispdispformée nnn 213
n3………….mol
Mélange n°5
Cu2+ + …OH-
Cu(OH)2
Etat initial
(avant réaction)
(1)n1initiale………mol n2initiale……….mol
Relation entre quantités initiales:
initialeinitiale nn 21
……………….en défaut
0
Quantités de
réactifs qui
disparaissent
dispdisp nn 21
(2)n1disp ………mol n2disp…………mol
Etat final
(après réaction)
(1)-(2)
n1final………….mol n2final=……. … mol
dispdispformée nnn 213
n3………….mol
Mélange n°8
Cu2+ + …OH-
Cu(OH)2
Etat initial
(avant réaction)
(1)n1initiale………mol n2initiale……….mol
Relation entre quantités initiales:
initialeinitiale nn 21
……………….en défaut
0
Quantités de
réactifs qui
dispdisp nn 21
 6
6
1
/
6
100%