les tissus conjonctifs

LES TISSUS CONJONCTIFS
I) Généralités sur les tissus conjonctifs
Chaque tissu se définit comme l’ensemble des cellules et structures extracellulaires qui ont en
commun certaines caractéristiques.
Les tissus conjonctifs servent à relier et soutenir, physiquement et biologiquement, les autres
constituants de l’organisme. Ils sont constitués de cellules (les fibrocytes) et d’une matrice
extracellulaire (ensemble de fibres très hydratées qui vont donner une organisation physique
au tissu et agir dans les échanges entre cellules).
Lorsqu’ils sont situés sous un épithélium, ils portent le nom de chorion, lorsqu’ils sont dans
un organe plein, ils portent le nom de stroma.
Les tissus conjonctifs sont partout dans l’organisme, associés à différentes cellules de
l’organisme, et en fonction de leur localisation et de leur composition, les tissus peuvent
acquérir des propriétés supplémentaires (c’est leur capacité d’adaptation).
A/ Les composants structuraux
Quelque soit leurs localisations, fonctions, et adaptations particulières, les tissus conjonctifs
ont en commun une structure et une organisation de base comportant toujours :
- des cellules : les fibrocytes
- une matrice extracellulaire organique faite d’un réseau de fibres de collagène, de
complexes macromoléculaires de protéines glycosylées (les protéoglycanes) et d’eau
contenant de nombreux éléments dissous (électrolytes, acides aminés, …)
B/ Les autres constituants
D’autres éléments peuvent être retrouvés dans certains tissus conjonctifs. Leur présence et
leur relative abondance modifient l’organisation du tissu conjonctif où ils se trouvent et
confèrent à celui-ci des propriétés mécaniques ou biologiques différentes et spécifiques.
On peut ainsi trouver :
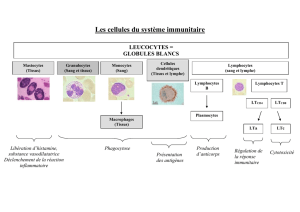
- des cellules (macrophages, lymphocytes, adipocytes)
- dans la matrice extracellulaire des fibres (élastiques, de réticuline) ou des cristaux de
phosphate de calcium
C/ Histogenèse des tissus conjonctifs
Les tissus conjonctifs sont issus de l’évolution du tissu mésenchymateux embryonnaire. Ce
dernier se forme principalement du mésoblaste, au cours des premières semaines de la vie
embryonnaire.
Les cellules mésenchymateuses peuvent se différencier en de nombreux types cellulaires
différents, présents dans l’organisme adulte :
- les fibroblastes des tissus conjonctifs
- les chondrocytes des tissus cartilagineux
- les ostéoblastes et les ostéocytes du tissu osseux
- les myocytes des tissus musculaires
- les cellules endothéliales qui tapissent l’intérieur des vaisseaux
- les cellules sanguines (hématies et leucocytes)
D/ Variétés des tissus conjonctifs
1) Tissus conjonctifs communs
- tissus conjonctifs lâches
- tissus conjonctifs denses (irréguliers, réguliers unitendus ou réguliers pluritendus)

2) Tissus conjonctifs spécialisés
- tissus adipeux
- tissus élastiques
- tissus réticulés
- tissus cartilagineux
- tissus osseux
1) a) Le tissu conjonctif lâche
Il est constitué d’un réseau collagène plus ou moins dispersé, disposé sans orientation
particulière. Le reste de la matrice extracellulaire est abondante et hydratée.
C’est lui qui supporte les épithéliums. Il possède des propriétés mécaniques assez modestes.
b) Les tissus conjonctifs denses
Ils comportent un réseau collagène épais, dense et serré. Le reste de la matrice extracellulaire
est peu abondante. Ils ont des propriétés mécaniques plus importantes alors que les propriétés
métaboliques sont moins marquées.
Les tissus conjonctifs denses irréguliers (ou non orientés) ont un réseau de collagène constitué
de fibres assez épaisses disposées sans orientation particulière.
Les tissus conjonctifs denses réguliers (ou orientés) ont une disposition régulièrement orientée
des fibres du réseau de collagène. Lorsque les fibres sont toutes dans le même sens on parle
de tissu unitendu. Lorsque les fibres se regroupent en faisceaux et que l’orientation des
faisceaux se fait dans plusieurs directions, on parle de tissu pluritendu.
2) Les tissus conjonctifs spécialisés se définissent comme des tissus conjonctifs qui ont
acquis des propriétés spécifiques en raison de la présence d’un ou de plusieurs
composants particuliers.
II) Structure et organisation des constituants
A/ Les composants structuraux
1°) Les fibroblastes
Le fibroblaste est une cellule allongée émettant de nombreux et fins prolongements plus ou
moins étendus. Le noyau de la cellule est ovoïde et aplati. Le cytoplasme apparaît souvent
réduit à une fine bande.
Le fibroblaste a des récepteurs à de nombreux facteurs de croissance et hormones.
L’activation de ces récepteurs conduit à la synthèse des composants de la matrice
extracellulaire et à la synthèse de cytokines (hormones à action locale).
2°) La matrice collagène
La matrice conjonctive est composée d’une matrice collagène et d’une matrice extracellulaire.
Le collagène est la protéine la plus abondante du monde animal et de l’organisme humain en
particulier. La polymérisation de la molécule (molécule de tropocollagène) est à l’origine de
fibres de collagène, de réseaux de collagène ou d’agrégats de collagène.
Les fibres de collagène sont flexibles mais ne sont pas extensibles. Le collagène est très
résistant aux agents chimiques et il est insoluble dans l’eau, à froid ou à 37°C. L’hydrolyse à
chaud (eau bouillante salée) le transforme en gélatine collante. Dans l’organisme, le collagène
est aussi résistant à la plupart des enzymes mais la collagénase le dégrade.

a) Aspects morphologiques
Le collagène peut être visualisé grâce à de nombreux colorants, en jaune par le safran, en rose
par l’éosine, en vert par le vert lumière, et en bleu par le bleu de méthyle.
Les fibres de collagène sont formées par la polymérisation de la molécule de tropocollagène.
Selon le degré de cette polymérisation, le collagène apparaît constitué :
- de faisceaux collagènes de 10 à 200µm
- de fibres de collagène de 1 à 10µm (plusieurs fibres s’associent en faisceaux)
- de fibrilles de collagène de 0,2 à 0,5µm (plusieurs fibrilles s’associent en fibres)
Les fibrilles sont composées de microfibrilles de plusieurs µm de long. En coupe transversale,
la microfibrille de collagène présente une striation régulière périodique de 67nm avec une
alternance de bandes claires et de bandes sombres.
b) Aspects biochimiques
Le collagène est une protéine fibrillaire dont la molécule, le tropocollagène mesure 240 à
280nm de long.
La molécule de collagène est composée de trois chaînes peptidiques élémentaires, les chaînes
α. Chaque chaîne α est spiralée sur elle-même et les spirales sont maintenues par des liaisons
hydrogènes. Les trois chaînes α sont torsadées ensemble et forment ainsi une triple hélice
stabilisée par des liaisons covalentes.
Dans la molécule de tropocollagène, les trois chaînes α sont orientées de la même façon, les
extrémités C-terminales se correspondent et dont du même côté (idem pour les N-terminales).
La molécule de tropocollagène est donc une molécule orientée.
De chaque côté de la triple hélice qui constitue la plus grande partie de la molécule, les
chaînes α se prolongent par un petit peptide non enroulé en triple hélice : les télopeptides. Il
existe donc un C-télopeptide et un N-télopeptide.
La polymérisation des molécules de tropocollagène est à l’origine de la microfibrille. Cette
polymérisation se fait toujours avec la même orientation de la molécule et dans les trois plans
de l’espace, avec un double décalage fixe.
Ce double décalage régulier fait
apparaître les bandes claires et les bandes
sombres.
Chaque chaîne α de la molécule de
tropocollagène comporte 1050 acides
aminés. Dans la partie en triple hélice, les
acides aminés sont disposés en triplet dont
le premier acide aminé est une glycine :
- (GLY-AA-AA) – (GLY-AA-AA) – etc.
La glycine représente donc 1/3 des acides
aminés de la triple hélice. C’est au niveau
de la glycine que la chaîne α forme une angulation responsable de la spiralisation de la chaîne.
Parmi les autres acides aminés, la proline, l’hydroxyproline, la lysine et l’hydroxylysine
représentent environ 1/3 des acides aminés.

De courtes chaînes glucidiques (galactose ou galactose-glucose) viennent se greffer le long
des chaînes α sur certains hydroxy-lysine.
c) Biosynthèse du collagène
La molécule de tropocollagène est synthétisée d’abord sous une forme précurseur : la
molécule de pré-tropocollagène. Trois gènes distincts sont impliqués dans le codage des trois
pro-chaînes α, à l’origine de trois ARN messagers distincts. Les trois pro-chaînes α
comportent 1250 acides aminés chacune. Ainsi, de chaque côté de la pro-chaîne α se trouve
une rallonge peptidique de 100 acides aminés, formant les peptides de coordination.
Au cours de l’élongation de la pro-chaîne peptidique, certains acides aminés vont être
hydroxylés. C’est notamment le cas de la proline en hydroxyproline (par la proline
hydroxylase) et de la lysine en hydroxylysine (par la lysine hydroxylase). Ces enzymes sont
spécifiques et ne reconnaissent l’acide aminé que s’il est situé dans une séquence précise
d’acides aminés (ainsi toute les prolines et lysines ne seront pas hydroxylées).
De courtes chaînes glucidiques (galactose ou galactose-glucose) sont greffées sur certains
résidus hydroxylysine. Les enzymes qui réalisent ces glycosylations sont également très
spécifiques et ne reconnaissent l’hydroxylysine que dans une séquence particulière (ainsi
toutes les hydroxylysines ne seront pas glycosylées).
Les trois pro-chaînes α terminées, hydroxylées et glycosylées s’assemblent par leurs
extrémités, les peptides de coordination.
Dans les espaces péri-cellulaires, les molécules de tropocollagène se disposent parallèlement
entre elles avec des décalages. Les molécules de tropocollagène contractent entre elles des
liaisons covalentes fortes qui impliquent la lysine, l’hydroxylysine et l’histidine. Ces acides
aminés, lorsqu’ils sont glycosylés, ne peuvent pas participer à ces liaisons covalentes. Un
collagène très glycosylé sera donc peu ou pas polymérisé.
L’enzyme qui réalise ces liaisons covalentes est la lysyl oxydase dont le cofacteur
indispensable est le cuivre. Les chélateurs de cuivre (substances favorisant l’élimination du
cuivre) inactivent l’enzyme avec pour conséquence, l’élaboration d’un collagène peu
polymérisé, peu stable et peu résistant.
d) Métabolisme du collagène
Lorsque le collagène est polymérisé, la molécule devient très résistante à la plupart des
enzymes de l’organisme, en dehors de la collagénase. Cette métalloprotéase détruit les
liaisons covalentes et dénature la triple hélice. Les autres protéases achèvent alors de dégrader
la molécule.
Ce processus enzymatique libérera donc des hydroxyprolines qui peuvent être dosées dans les
urines, et des C et N télopeptides qui peuvent être dosés dans le sérum. Ces éléments sont
considérés comme des indicateurs du catabolisme du collagène.
Certains collagènes seront renouvelés rapidement, il s’agit donc de collagènes peu
polymérisés. D’autres seront renouvelés en plusieurs mois ou années (ils sont généralement
très polymérisés).
e) Les types de collagène
Lorsque les trois chaînes α sont identiques, la formule est : (α1)3
Lorsque deux chaînes sont identiques et la troisième différente : (α1)2 – α2
Lorsque les trois chaînes sont différentes : α1 – α2 – α3

Certains collagènes vont former des microfibrilles : types I, II, III, V et XI
D’autres vont former des réseaux : types IV, VIII et X
D’autres vont former des agrégats : types VI et VII
Les FACIT sont des collagènes distincts des formes microfibrillaires car ils incluent des
portions qui ne sont pas en triple hélice : types IX, XII, XIV, XVI et XIX
3°) La matrice extracellulaire non collagène (substance fondamentale)
C’est un milieu très hydraté contenant également des glycoprotéines. Elle sert d’espace de
transit pour les substances dissoutes dans la phase aqueuse.
En microscopie photonique, la matrice extracellulaire non collagène n’est pas visible. Certains
colorants, en se liant à des composés de cette matrice permettent de la visualiser (bleu de
toluidine).
La matrice extracellulaire non collagène est composée de protéoglycanes, de protéines et de
substances dissoutes.
a) Les protéoglycanes
Ce sont des complexes macromoléculaires associant une protéine porteuse sur laquelle
viennent se greffer les glycosaminoglycanes. Les glycosaminoglycanes sont des polymères
glucidiques d’unités disaccharidiques. Selon leur composition en glycosaminoglycanes, les
matrices sont plus ou moins hydratées et rigides.
Sept types d’unités différentes peuvent être impliqués :
- acide hyaluronique (plus hydrophile que les autres)
- chondroïtine 4S
- chondroïtine 6S
- Dermatane S
- Kératane S
- Héparane S
- Héparine
Ces unités disaccharidiques vont polymériser pour former des chaînes, le plus souvent
homogènes, et plus ou moins longues :
♦ 10 à 20 unités disaccharidiques pour les chaînes courtes
♦ 40 à 60 unités pour les chaînes moyennes
♦ 2000 à 2500 unités pour les chaînes longues
Les chaînes de glycosaminoglycanes se lient par l’une de leurs extrémités à une protéine
porteuse par l’intermédiaire d’un oligosaccharide d’union formé le plus souvent de :
GALACTOSE – GALACTOSE – XYLOSE
Le xylose de l’oligosaccharide d’union est relié à un acide aminé de type sérine de la protéine
porteuse.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%