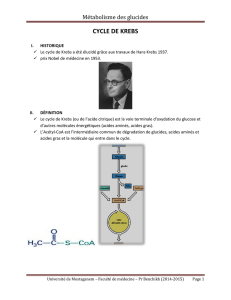
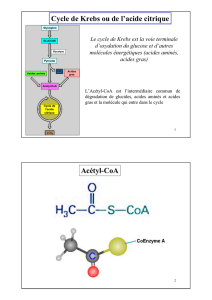
Les différentes étapes du cycle de KREBS

Les différentes étapes du cycle de KREBS
Condensation de l’AcétylCoA avec de l’acétate pour former le citrate. Cette réaction est
catalisée par la citrate synthase. Le carbone provenant du pyruvate se lie au groupement
carbonyle de l’oxalo acétate
Formation d’un intermédiaire transitoire. Induit un groupement transitoire, le citroïle
conenzymeA. Cet intermédiaire est formé sur le site actif de l’enzyme et subit
rapidement une hydrolyse pour fournir du coenzymeA libre et du citrate qui sont alors
libérés du site actif de l’enzyme. Ce composé intermédiaire n’est pas libéré, il reste lié au
site actif de l’enzyme. L’oxaloacétate se fixe en premier sur la citrate synthase et induit
un changement de conformation de cet enzyme qui révèle un site de liaison pour le
second substrat l’acétylCoA quand l’intermédiaire de la réaction, le citroïle CoA se forme
à la surface de l’enzyme, un autre changement de conformation permet le clivage de la
liaison thio-ester de cet intermédiaire. L’hydrolyse de cet intermédiaire thio-ester à
haute énergie rend cette réaction fortement exergonique (dG° lié à -32Kj/mol) qui est
irréversible dans les conditions physiologiques. Cette variation d’énergie libre fortement
négative est nécessaire au bon fonctionnement du cycle. En effet les concentrations
d’oxaloacétate reçus sont très faibles. Le CoA formé par cette réaction est recyclé pour
participer à la décarboxylation oxydative d’une nouvelle molécule de pyruvate par le
complexe de la pyruvate déshydrogénase.
Isomérisation en hydrocyclase
Est l’enzyme qui assure l’isomérisation réversible du citrate en isocitrate. Cette réaction
est réalisée en 2 étapes :
Formation d’un intermédiaire, le cis-aconitate qui ne se dissocie pas du site actif
de l’enzyme.
Il y a en premier une déshydratation du citrate suivi d’une hydratation du
Cis-aconitate.
Le mélange à l’équilibre contient moins de 10% d’isocitrate mais dans le cycle, la
réaction conduit à produire ce composé car il est utilisé rapidement par l’étape suivante
du cycle.
L’aconitase est un enzyme qui contient un centre Fer-Souffre, qui permet à la fois la
fixation du substrat et la catalyse des deux étapes de la réaction, c’est à dire l’élimination
puis l’addition d’une molécule d’eau. L’aconitase est la cible d’un poison d’origine
végétale, le fluoro acétate qui est utilisé comme raticide. Ce composé est le fluoro
acétate, il n’est pas toxique par lui même mais il est transformé par la citrate synthase en
fluoro-citrate qui inhibe l’aconitase, ceci bloque ainsi le fonctionnement du cycle de
KREBS.
Etape suivante est décarboxylation oxydative de l’isocitrate, c’est la première des 4
réactions du cycle de KREBS. Cette décarboxylation oxydative de l’isocitrate est
catalysée par l’isocitratedéshydrogénase.
Réaction en 2 étapes :
- Déshydrogénation de l’isocitrate.
- Formation de NADH et d’un composé intermédiaire l’oxalosuccinate. Cette
oxalosuccinate est un composé instable qui subit spontanément une
décarboxylation conduisant à la production d’α-cétoglutarate qui est le
produit final de cette réaction.
Il existe 2 formes différents d’isocitratedéshydrogénase, une utilise le NAD+ comme
coenzyme, et l’autre le NADP +. Les réactions catalysées par ces deux enzymes sont

identiques. L’enzyme dépendant du NAD est exclusivement localisé dans la matrice
mitochondriale et c’est cette forme qui est impliqué dans le cycle de l’acide citrique.
L’enzyme dépendant du NADP est lui localisé à la fois dans la matrice mitochondriale et
dans le cytosol.
Décarboxylation oxydative de l’α-Cétoglutarate.
Cette réaction très exergonique est catalysée parle complexe de l’alpha cétoglutarate
déshydrogénase, cette réaction conduit à la formation de succinyl-CoA et de gaz
carboniques. Cette réaction est en fait très semblable à celle catalysée par la pyruvate
déshydrogénase.
Ces deux réactions impliquent l’oxydation d’un acide α-cétonique avec perte du
groupement carboxyle sous forme de gaz carboniques. A la fois dans sa structure et dans
son fonctionnement, le complexe de l’α-cétoglutarate déshydrogénase ressemble au
complexe de la pyruvate déshydrogénase. Il comprend 3 enzymes analogues à E1, E2 et
E3 de la pyruvate déshydrogénase et il utilise les même 5 CoA (TVP, acide bucoique, FAD
MAD et CoA).
Les enzymes E1 des deux complexes présentent de grandes similitudes structurales,
cependant leur séquences en acide aminé sont différentes et ce sont eux qui assurent la
spécificité de substrat de leur complexe enzymatique respectif en fixant spécifiquement
soit l’α-cétoglutarate soit le pyruvate. Les enzymes E2 et E3 des deux complexes sont
eux pratiquement identiques, en particulier les enzymes E2 possèdent tous deux es
groupement hypoïles. Cette réaction conduit à la formation de NADH et de gaz
carbonique d’une part et d’autre part à la formation d’un composé à 4 carbones qui est
activé par liaison avec une molécule de CoA. Il s’agit du succinyl CoA qui contient donc
une liaison thioester riche en énergie.
Formation du succinate
La liaison Thio-ester riche en énergie du succinyl CoA est clivée en présence de
phosphate inorganique et de GDP pour donner du GTP et du succinate. C’est une
réaction réversible qui est catalysée par la succinyl CoA synthétase (Succinyl
thiokinase). La production d’une liaison phosphate riche en énergie à partir du succinyl
CoA est un exemple de phosphorylation au niveau du substrat tel qu’il en existe dans la
glycolyse. On appelle cette réaction phosphorylation au niveau du substrat par ce que
l’énergie nécessaire pour qu’elle s’accomplisse provient de la déshydrogénation d’une
molécule de substrat organique. Ces réactions sont distinctes de la phosphorylation
oxydative qui elle est couplée au transport d’électrons au niveau de la chaine
respiratoire. Cette réaction qui conserve l’énergie implique une étape intermédiaire au
cours de laquelle la molécule d’enzyme elle même est phosphorylée. On peut décrire 3
étapes pour cette réaction :
- 1 : Groupement phosphate remplace le Coenzyme A dans le succinylCoA lié à
l’enzyme. Ceci forme un succinyl phosphate riche en énergie.
- 2 : Succinyl phosphate donne son groupement phosphate à un résidu histidine
de l’enzyme. Il y à formation d’un phosphohistidine enzyme à haute énergie.
- 3 : Le groupement phosphate est transféré du résidu histidine au GDP pour
former le GTP.
Le GTP former peut à son tour donner son groupement phosphate terminal à l’ATP pour
former de l’ADP grâce à l’action réversible de la nucléoside diphosphate kinase.

Déshydrogénation du succinate.
Oxydation réversible du succinate catalysé par la succinate déshydrogénase. Cet enzyme
contient des groupement fer-souffre et des molécules de FAD liées par covalence à un
résidu histidine. Ce CoA prend en charge les deux atomes d’hydrogène portés par les
deux carbones centraux du succinate pour former le fumarate qui contient donc une
double liaison.
Caractéristique importante : Activité de cet enzyme est stéréospécifique. Seul
l’isomère TRANS-FUMARATE est formé.
La succinate déshydrogénase est intégré à la membrane interne de la mitochondrie, c’est
le seul enzyme du cycle de l’acide citrique qui soit lié à une membrane
Hydratation du fumarate
Hydratation réversible du fumarate en L-Malate catalysé par la fumarase. Enzyme
stéréospécifique, il catalyse l’hydratation de la double liaison du fumarate pour former
le L-malate. Cet enzyme n’a pas d’effet sur l’isomère CIS du fumarate qui s’appelle le
maléate. Ce maléate n’est pas substrat de la fumarate.
Oxydation du malate
Réaction réversible qui est catalysée par la L-malate déshydrogénase dont le Coenzyme
est le NAD+ cette réaction conduit à la formation d’oxaloacétate.
Réaction à lieu dans le sens de la formation de L-malate dans la mitochondrie,
l’oxaloacétate est continuellement utilisée par la réaction catalysée par la citrate
synthase qui est fortement exergonique. Ceci maintient à un niveau très bas les
concentrations d’oxaloacétate, conduisant la réaction catalysée par la malate
déshydrogénase vers la formation de celle d’oxaloacétate.
L’oxaloacétate formé pourra réagir avec une nouvelle molécule d’acétylCoA pour former
du citrate et on recommence le processus …
Bilan Global
Au cours d’un tour de cycle, un groupement acétyle comprenant 2 atomes de C a été
apporté au cycle est se trouve combiné à l’oxaloacétate.
A l’inverse 2 atomes de C sortent du cycle sous forme de gaz carbonique au cours de
l’isomérisation de l’isocitrate et de l’α-cétoglutarate.
A la fin du cycle une molécule d’oxaloacétate est régénérée.
Les deux atomes de carbones qui apparaissent sous forme de gaz carbonique ne sont pas
les 2 carbones provenant du pyruvate et apporté par l’acétylCoA.
Des tours supplémentaires de cycles sont nécessaire pour que les atomes de carbone
entrés sous forme de groupement acétyl apparaissent finalement sous forme de gaz
carboniques.
Le cycle de l’acide citrique génère directement une molécule d’ATP par phosphorylation
au niveau du substrat au cours de la transformation du succinyl CoA en succinate.
Les 4 réactions d’oxydation fournissent un flux d’électrons par intermédiaire de 3
molécules de NADH et d’une molécule de FADH2

Pour le NADH c’est au cours des réactions catalysées par l’isocyclate déshydrogénase,
l’α-cétoglutarate déshydrogénase et la malate déshydrogénase.
Pour le FADH2 c’est au cours de la réaction catalysée par la sulfinate déshydrogénase.
Dans la chaine respiratoire ces électrons conduiront à la formation d’ATP par
phosphorylation oxydative. D’un point de vu énergétique chaque NADH préoxydé par la
chaine respiratoire permet la formation de 3 ATP
Rendement énergétique globale
À partir de 2 molécules de pyruvate tout le cycle.
Bilan globale = 2 ATP produites
2 NADH produit 6 ATP
AcétylCoA 2 NADH 6 ATP
1 tour de cycle 12 ATP :
2 acétyle CoA 2 tour de cycle 24 ATP
Dans les voies métaboliques les enzymes clés sont régulées par des *** allostériques et
par des modifications covalentes pour assurer la formation des produits à des vitesse
nécessaires au maintient de l’intégrité cellulaire, mais aussi pour limiter la
surproduction.
Le flux des atomes de carbone venant du pyruvate à travers le cycle de KREBS est régulé
à plusieurs niveaux.
- Au niveau de la transformation du pyruvate en Acétyl CoA (niveau du
complexe de la pyruvate déshydrogénase)
- Au niveau de l’entrée de l’Acétyl CoA dans le cycle
- Isocitrate déshydrogénase
- Α-Cétoglutérate désydrogénase
Régulé à la fois par des modulateurs allostériques et par des modifications covalentes.
Ce complexe est limité par le produit de la réaction que sont l’ATP l’AcétylCoA et le
NADH. Ces régulateurs allostériques sont complétés par un autre niveau de régulation
mettant en jeu la modification covalente des enzymes.
L’enzyme E1 : pyruvate décarboxylase est inhibée par la phosphorylation réversible
d’un résidu Sérine. Cette régulation est assurée par des enzymes qui sont partie
intégrante du complexe de la pyruvate déshydrogénase à côté de E1, E2, E3. Une
protéine kinase spécifique phosphoryle E1 et ainsi inactive cet enzyme. Un phosphate
retire ce phosphate par hydrolyse activant ainsi l’enzyme E1. En conséquence, quand les
concentration d’ATP sont élevées, c’est à dire apport suffisant d’énergie à la cellule, la
kinase est activée ce qui conduit à la phosphorylation de E1 et à une diminution de
l’activité du complexe
Quand les concentrations en ATP diminuent l’activité de la kinase diminue, l’activité de
la phosphatase augment, ce qui déphosphoryle l’enzyme E1 et ainsi active le complexe.
L’activité du complexe régulé suivant les besoins de la cellule en énergie.
3 autres étapes du cycle sont régulées :
- La citrate synthase qui est inhibée de manière allostérique par l’ATP. Le cycle
de l’acide citrique est freiné quand la cellule dispose d’assez d’ATP.
- L’isocitrate déshydrogénase est également régulée le régulateur majeur est
l’ADP qui est un activateur allostérique de l’enzyme
- L’α-cétoglutarate de l’hydrogénase est inhibé par des produits de la réaction :
succinyl CoA et NADH. Ces dernières régulations permettent un couplage

entre les chaines de transport d’électrons qui réoxydent le NADH et la
production de cette molécule. Globalement les vitesses de la glycolyse et du
cycle de KREBS sont intégrés de tels sorte que les quantité de glucose
métabolisé en pyruvate sont celles nécessaire pour fournir des groupement
acétyl au cycle de l’acide citrique.
Le cycle de l’acide citrique ne sert pas seulement au catabolisme oxydatif des glucides,
des acides gras, des acides aminés, il fournit également les précurseurs à de nombreuses
voies de biosynthèse. L’α-cétoglutarate qui est à l’origine de la formation d’acides
aminés tel que le glutamate, la glutamine, la proline et l’arginine. Le succinyl CoA est le
précurseur de l’hème de l’hémoglobine
L’oxaloacétate est le Précurseur des glucides mais aussi de l’aspartate et de l’asparagine.
Ces intermédiaires retirés du cycle pour servir de précurseurs de biosynthèse sont
régénérés par un ensemble d’enzyme pour maintenir un équilibre dynamique assurant
des concentrations relativement constantes de ces intermédiaires. Ces réactions de
régénérations de ces intermédiaires sont appelées réactions de remplissage ou des
réaction anaplérotiques. Dans les tissus animaux la plus importante de ces réactions est
catalysée par le pyruvate carboxylase qui conduit la formation d’oxaloacétate
Phosphorylation oxydative
Dans le cycle de l’acide citrique aucune des réactions conduisant à la production de
NADH ou de FADH2 n’utilise l’oxygène moléculaire par contre les réactions finales qui se
produisent sur la membrane mitochondriale interne consomme directement de
l’oxygène atmosphérique. L’énergie disponible provenant du catabolisme des glucides et
d’autres matière est stocké par le NADH ou le FADH2 sous forme d’électrons à haute
énergie pris au substrat au cours des étapes d’oxydations porté par le NADH et le FADH2
sont ensuite combiné à l’oxygène par l’intermédiaire de la chaine respiratoire.
La grande quantité d’énergie ainsi libérée est récupérée pour permettre la synthèse
d’ATP. Ces dernières réactions sont appelés phosphorylation oxydatives.
La production d’ATP par la phosphorylation oxydative via la chaine respiratoire dépend
d’un processus chimio-osmotique
Il n’y a pas d’une liaison riche en énergie entre un groupement phosphate et un
composé. La formation d’ADP à partir de l’ADP n’utilise donc pas l’énergie libéré par la
rupture d’une telle liaison. Ces intermédiaires chimiques riches en énergie sont
remplacés par une association entre un processus chimique et des processus de
transport osmotique. Les électrons à haute énergie provenant du NADH et du FADH2
parcours la chaine respiratoire dans la membrane mitochondriale interne. L’énergie
libérée au cours de leur passage d’un transporteur au suivant est utilisé pour pomper les
protons à travers la membrane interne depuis la matrice mitochondriale vers l’espace
inter membranaire.
Ceci produit un gradient de proton à travers la membrane mitochondriale interne
Le reflux de protons dans le sens de ce gradient est utilisé pour activer un enzyme
membranaire qu’on appelle l’ATPsynthase qui catalyse la conversion ADP+ Phosphate
inorganique en ATP
1
/
5
100%