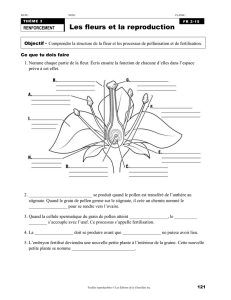
Le gamétophyte mâle ou grain de pollen

Le gamétophyte mâle
Les Angiospermes et les mammifères utilisent des mécanismes très différents pour produire
leurs gamètes. Alors que les mammifères possèdent une lignée germinale établie très tôt
durant l’embryogenèse, la spécification des cellules germinales s’effectue très tardivement
durant le développement chez les Angiospermes. Le développement du gamétophyte mâle y
met en œuvre une série d’événements qui aboutissent à la production, puis à la libération des
grains de pollen mûrs, destinés à assurer la pollinisation. Le grain de pollen mûr
d’Arabidopsis présente ceci de particulier qu’il s’agit en fait d’une large cellule qui contient
deux petites cellules dont la fonction est très spécialisée, puisqu’il s’agit des deux gamètes
mâles. Le cytoplasme de la grande cellule dite « végétative » va transporter dans le tube
pollinique les gamètes mâles à travers les tissus pour les « relacher » à proximité du gamète
femelle et de la cellule centrale du sac embryonnaire.
Toutes les étapes du développement du grain de pollen se déroulent au sein de l’étamine, et
plus précisément des loges polliniques de l’anthère. Nous ne détaillerons cependant pas ici la
succession des étapes qui permettent la formation de l’anthère, le déroulement de la méïose,
ni la déhiscence de l’anthère, pour focaliser notre attention sur le gamétophyte mâle.
Premières étapes
L’anthère, puis plus tard la gamétogenèse mâle sont initiées, à partir de l’assise cellulaire L2
du méristème apical caulinaire. La formation des gamètes est initiée par des divisions
périclines, c’est-à-dire parallèles à la paroi de l’anthère, de cellules de l’hypoderme (ou assise
sous épidermique) qui produisent des archéspores. Celles-ci se divisent pour former les
cellules sporogènes primaires, qui en se divisant à leur tour forment les cellules primaires
pariétales (ou CPP) et les cellules mères du pollen (CMP) encore nommées cellules primaires
sporogènes, dont il existe une trentaine par anthère chez Arabidopsis. La CPP formera
ultérieurement plusieurs assises cellulaires de la paroi de l’anthère, destinées à différencier un
endothecium, une assise médiane et une assise interne dénommée « tapis », cette dernière
entourant les cellules sporogènes. Les CMPs produiront les microsporocytes. Il ne fait aucun
doute que ces processus possèdent un contrôle génétique. Le développement de grains de
pollen viables requiert la présence du tapis, de même que la présence d’autres assises est

nécessaire pour les mécanismes impliqués dans la déhiscence des loges polliniques. La
microsporogenèse et la microgamétogenèse sont détaillées dans les articles de Ma (2005), de
Boavida et al. (2005), McCormick (2004) et Wilson et Yang (2004). Nous nous contenterons
donc, ici, de résumer les principaux événements qui surviennent durant la gamétogenèse.
Production des microspores
Lorsque la méïose est initiée, un ensemble de type cœnocytique est constitué, du fait de la
présence de très larges plasmodesmes dénommés canaux cytomictiques, qui créent ainsi un
continuum cytoplasmique entre les groupes de cellules. Ceci autorise d’ailleurs une excellente
synchronisation durant la microsporogenèse. Les microsporocytes sont enchassés dans une
paroi de callose (beta-1,3-glucane) « isolant » les méîocytes des cellules sporophytiques. A
partir de chaque microsporocyte (ou cellule mère du pollen) diploïde, la méîose conduit à une
tétrade de microspores haploïdes, chacune possédant sa propre enveloppe de callose. Au sein
d’une tétrade, les quatre microspores sont individualisées, sous l’action d’une callase produite
par les cellules du tapis, qui dégrade les liaisons entre les parois des microspores. De plus, les
quatre micropsores demeurent un moment contenues dans la mince paroi de callose entourant
la tétrade. Cette enveloppe de la tétrade va disparaître sous l’action d’une glucanase produite
par les cellules du tapis. A ce stade chaque microspore est individualisée. Durant la méïose,
les populations de plastes et de mitochondries se sont dupliquées puis ont été réparties entre
les éléments de la tétrade. Dans chaque microspore, une paroi se dépose à la périphérie,
l’exine, visible dès le stade tétrade.
Le gène Tetraspore (TES)/Stud (STD) code une kinésine impliquée dans la cytokinèse
méïotique, et sa mutation entraine l’absence de microtubules, donc la formation d’une large
microspore tétranucléée dans un seul cytoplasme. Ceci conduira à des grains de pollen
volumineux et miltinucléés, avec au stade ultime jusqu’à quatre paires de noyaux
reproducteurs (Yang CY et al., 2003). Plusieurs mutations affectent la séparation des
microspores, notamment celle du gène Quartet1 (QRT) qui code une pectine méthylestérase
(Francis et al., 2006). Ce gène (sporophytique) est exprimé dans le tapis. Sa mutation qrt1
entraîne la formation de tétrades qui ne séparent pas les microspores fusionnées au niveau de
leurs parois (Francis et al., 2006). L’absence de séparation résulte de la conservation des
composés pectiques dans la paroi, néanmoins, le pollen isolé manuellement est capable de
féconder.

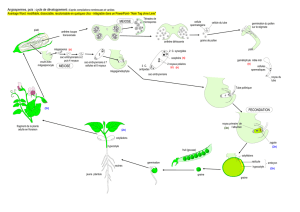
Achèvement de la gamétogenèse mâle
Après leur séparation, les microspores, haploïdes, réorganisent leur cytoplasme, avec
notamment la fusion de petites vacuoles qui constituent alors une seule vacuole de grande
taille. Ceci entraîne une accumulation de la majeure partie du cytoplasme sur la périphérie de
la microspore, avec le noyau disposé latéralement. C’est l’orientation oblique du fuseau
mitotique qui, lors de la cytokinèse, produira deux cellules très différentes (figure 1). Cette
polarisation correspond à une première division asymétrique, la première mitose pollinique
(PM I). Cette asymétrie va entrainer la formation de deux noyaux frères de tailles différentes,
un important noyau dit végétatif (NV), et un petit noyau dit reproducteur (NR). De plus, les
contenus cytoplasmiques des deux cellules sont très différents, avec un cytoplasme dense,
riche en lipides, en protéines et en carbohydrates, dans la cellules végétative qui ne se divisera
plus. La cellule reproductrice possède un noyau plus « condensé ». Les deux cellules filles
auront des devenirs différents, avec la cellule reproductrice englobée dans la cellule
végétaive. Alors que chez beaucoup d’espèces comme le tabac, la seconde division pollinique
(PM II) se déroule après la pollinisation, dans le tube pollinique, chez les Poaceace ou les
Brassicaceae par exemple, le noyau reproducteur va se diviser et donner deux noyaux
reproducteurs (deux cellules contenant les gamètes mâles) avant la pollinisation (Friedman,
1999). De ce fait, chez Arabidopsis, les deux noyaux reproducteurs sont en phase G1 du cycle
cellulaire au moment de la pollinisation, et c’est dans le tube pollinique qu’ils vont effectuer
leur synthèse d’ADN, pour arriver au moment de la fécondation en phase G2 du cycle
cellulaire (Friedman, 1999). Lorsque le pollen mûr des Angiospermes est relaché, lors de la
pollinisation, il possède une teneur en eau très limitée (15 à 30%), correspondant à un très fort
ralentissement du métabolisme. Dès qu’il atteint le stigmate, le pollen va se réhydrater, puis
germer.
Informations apportées par les mutants
L’observation de différentes altérations de la morphologie du grain de pollen, en termes de
nombre de cellules, nombre de noyaux, type de division, a permis d’identifier plusieurs
classes de mutants, affectant PM I ou PM II (figure 2). Une large part de ces mutants
correspondent à des fonctions exercées par les cellules du tapis (sporophyte). En ce qui
concerne les gènes exprimés dans le pollen (gamétophytiques), du fait de l’haploïdie du
pollen les mutations nulles ne seront pas transmises par ce pollen. Elles ne seront exprimées
que dans 50% des grains de pollen de l’hétérozygote. Le premier identifié en tant que gène
exprimé dans le gamétophyte a été le mutant scp (pour sidecar pollen). Ce mutant présente la

particularité, dans une partie des microspores, de débuter ses divisions par une division
symétrique additionnelle, qui met en place deux noyaux de type « végétatif ». L’un de ces
noyaux va ensuite permettre la mise en place des deux gamètes mâles. Le pollen est en finale
doté d’une cellule surnuméraire, au moins dans une partie de la population de graisn de pollen
d’une plante hétérozygote pour scp. Chez le mutant tio (two in one) le pollen mûr contient
deux noyaux, du fait d’une anomalie de la cytokinèse en PMI (Oh et al., 2005). Le gène TIO
code une sérine/thréonine kinase de type NIMA/NEK (Never In Mitosis), jouant un rôle dans
la mise en place du plateau cellulaire durant la cytokinèse, mais ce gène n’est pas spécifique
des gamétophytes mâles et femelles, puisqu’il affecte également les cellules somatiques. Le
gène Solo Dancer code une cycline. La mutation dans ce gène bloque la PMI, ce qui conduit à
la production de pollen unicellulaire (Azumi et al., 2002). Le gène Gemini pollen (GEM1 ou
encore MOR1) code une protéine associée aux microtubules ou MAP. Sa mutation affecte la
polarité et l’asymétrie de la PM1, ainsi que le devenir cellulaire des deux cellules filles (Park
et al., 1998 ; Twell et al., 2002). En effet, durant la cytokinèse, chez le mutant gem1, le
phragmoplaste est mal positionné, entraînant une PMI moins asymétrique, avec des cellules
jumelles. L’arrêt après la PMI produit donc un pollen mûr binucléé.
Le gène DUO1 code un facteur de transcription de type MYB R2-R3, spécifique de la lignée
germinale. Sa mutation, duo1, bloque la PMII, et de ce fair ne permet pas de produire les deux
gamètes mâles (Rotman et al., 2005 ; Durbarry et al., 2005), mais une seule cellule
reproductrice présentant un contenu en ADN de 2C ou plus, suggérant l’entrée dans un
endocycle. Chez le « sauvage », la protéine DUO1 est localisée dans le noyau reproducteur et
dans les deux noyaux gamétiques (Rotman et al., 2005). Deux hypothèse alternatives ont été
faites concernant la fonction de DUO1 : soit le contrôle de la division du noyau reproducteur
par une activation de cibles spécifiques comme les cyclines, soit la régulation du point de
contrôle G2 / M.
Beaucoup d’autres mutaions ont été décrites, qui affectent par exemple l’organisation
générale du pollen : position du noyau végétatif, absence de migration des noyaux, etc…. De
nombreux autres mutants demeurent à découvrir. En effet, les données transcriptomiques de
Pina et al. (2005), Becker et al. (2003) et Honys et Twell (2004) montrent que si très peu de
gènes ne sont exprimés que dans le pollen, beaucoup des gènes d’Arabidopsis (15 à 25%)
présentent une expression durant la gamétogenèse mâle. De telles analyses permettront de
sélectionner des gènes candidats pour les analyses fonctionnelles ultérieures.

Concrètement, il faut noter que si près de 14000 gènes sont exprimés dans le gamétophyte
mâle, près de 10000 sont exprimés dans la microspore, mais il n’y en a plus que près de 5000
exprimés dans le pollen mûr. Environ 10% des gènes exprimés dans le pollen ne sont pas
exprimés dans les tissus sporophytiques (Becker et al., 2003). Enfin, il est très important de
noter que les données de Pina et al. (2005) et de Honys et Twell (2004) montrent que les
ARNs codant des éléments de signalisation et des protéines pariétales sont sur-représentés
dans le pollen, alors que les facteurs de transcription sont sous représentés, comparativement
aux tissus sporophytiques. Leurs données indiquent en outre une inactivation des voies
« petits ARNs » dans le pollen mûr.
Références
Azumi Y, Liu D, Zhao D, Li W, Wang G, Hu Y, Ma H 2002 Homolog interaction during
meiotic prophase I in Arabidopsis requires the SOLO DANCERS gene encoding a novel
cyclin-like protein. EMBO J 21: 3081-3095
Becker JD, Boavida LC, Carneiro J, Haury M, Feijo JA 2003 Transcriptional profiling of
Arabidopsis tissues reveals the unique characteristics of the pollen transcriptome. Plant
Physiol 133: 713-725
Boavida LC, Becker JD, Feijo JA 2005 The making of gametes in higher plants. Intl J Dev
Biol 49: 595-614
Chen YC, McCormick S 1996 Sidecar pollen, an Arabidopsis thaliana male gametophytic
mutant with aberrant cell divisions during pollen development. Development 122: 3243-
3253
Durbarry A, Vizir I, Twell D 2005 Male germ line development in Arabidopsis. duo pollen
mutants reveal gametophytic regulators of generative cell cycle progression. Plant Physiol
137: 297-307
Francis KE, Lam SY, Copenhaver GP 2006 Separation of Arabidopsis pollen tetrads is
regulated by QUARTET1, a pectin methylesterase gene. Plant Physiol 142: 104-1013
Friedman WE 1999 Expression of the cell cycle in sperm of Arabidopsis: implications for
understanding patterns of gametogenesis and fertilization in plants and other Eukaryotes.
Development 126: 1065-1075
Honys D et Twell D 2004 Transcriptome analysis of haploid male gametophyte development
in Arabidopsis. Genome Biology 5: R85
Ma H 2005 Molecular Genetic analyses of microsporogenesis and microgametogenesis in
flowering plants. Annu Rev Plant Biol 56: 393-434
McCormick S 2004 Control of male gametophyte development. The Plant Cell 16 suppl:
S142-S153.
Oh SA, Johnson A, Smertenko A, Rahman D, Park SK, Hussey PJ, Twell D 2005 A divergent
cellular role for the FUSED kinase family in the plant-specific cytokinetic phragmoplast.
Curr Biol 15:2107-2111
Park SK, Howden R, Twell D 1998 The Arabidopsis thaliana gametophytic mutation gemini
pollen1 disrupts microspore polarity, division asymmetry and pollen cell fate.
Development 125: 3789-3799
 6
6
1
/
6
100%