FICHE MEMO ESPECES CHIMIQUES USUELLES

FICHE D'AIDE EN CHIMIE
FICHE MEMO ESPECES CHIMIQUES USUELLES
(entre parenthèses espèces usuelles en chimie au lycée mais dont le nom et la formule ne
sont pas exigibles)
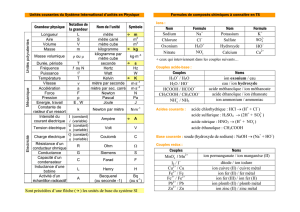
1. Espèces monoatomiques/métaux
ETAT PHYSIQUE
NOM
FORMULE
Alcalins
lithium
sodium
potassium
rubidium
césium
Li
Na
K
(Rb)
(Cs)
Métaux
Alcalino-terreux
Béryllium
Magnésium
Calcium
Strontium
Baryum
Radium
Be
Mg
Ca
(Sr)
Ba
(Ra)
Autres métaux
fer
cuivre
zinc
aluminium
plomb
argent
étain
or
nickel
Fe
Cu
Zn
Al
Pb
Ag
(Sn)
(Au)
(Ni)
Non-métaux
carbone
soufre
C
S
Gaz nobles
hélium
néon
argon
krypton, xénon, radon
He
Ne
Ar
(Kr, Xe, Rn)
2. Espèces moléculaires
eau H2O
dihydrogène H2
dioxygène O2
diazote N2
difluor, dichlore, dibrome, diiode F2, Cl2, Br2, I2
monoxyde de carbone CO
monoxyde d’azote NO
dioxyde de carbone CO2
dioxyde d’azote NO2
dioxyde de soufre SO2
ammoniac NH3
chlorure d'hydrogène (acide chlorhydrique) HCl
sulfure d'hydrogène (acide sulfureux) H2S
acide nitrique HNO3
acide sulfurique H2SO4
acide méthanoïque (formique) HCOOH

acide éthanoïque (acétique) CH3CO2H
méthane CH4,
éthane C2H6
propane C3H8
butane C4H10
éthène C2H4
éthanol C2H5OH
éthanal CH3CHO
propanone CH3COCH3
éthanoate de méthyle CH3COOCH3
anhydride éthanoïque CH3COOCOCH3
eau oxygénée H2O2
(acide ascorbique (vitamine C)) C6H8O6
glucose (ou fructose) C6H12O6
saccharose (sucre) C12H22O11
benzène C6H6
acide benzoïque C6H5CO2H
glycérol CH2OH-CHOH-CH2OH
3. Espèces ioniques
ion oxonium (hydronium) H+ (ou H3O+)
ion hydroxyde OH-
ions chlorure, chlorure, iodure, bromure F-, Cl-, I-, Br-
ions lithium, sodium, potassium Li+, Na+, K+
ions magnésium, calcium, baryum Mg2+, Ca2+, Ba2+
ion argent Ag+
ion zinc Zn2+
ion cuivre (II) Cu2+
ion plomb (II) Pb2+
ion manganèse Mn2+
ion aluminium Al3+
ions fer (II), fer (III) Fe2+, Fe3+
ion ammonium NH4+
ion carbonate, hydrogénocarbonate (bicarbonate) CO32-, HCO3-
ions sulfate, hydrogénosulfate SO42-, HSO4-
(ion phosphate) PO43-
ion nitrate NO3-
(ion thiocyanate) SCN-
ion permanganate Mn04-
(ion thiosulfate) S2O32-
(ion tétrathionate) S4O62-
(ion oxalate) C2O42-
ion méthanoate (formiate) HCOO-
ion éthanoate (acétate) CH3CO2-
ion carboxylate (formule générale) RCO2-
(ion éthanolate) C2H5O-

4. Formules statistiques de solides ioniques
Ci-dessous ne figurent que quelques exemples, les noms se trouvent facilement à partir de
l'association "nom de l'anion" "de" "nom du cation" :
chlorure de sodium (sel) NaCl
sulfate de cuivre CuSO4
nitrate d'argent AgNO3
sulfate de sodium Na2SO4
nitrate de plomb Pb(NO3)2
hydroxyde de sodium (soude) NaOH
hydroxyde de potassium (potasse) KOH
hydroxyde de cuivre Cu(OH)2
hydroxyde d'aluminium Al(OH)3
éthanoate de potassium CH3CO2Na
iodure de plomb PbI2
sulfate d'ammonium (NH4)2SO4
oxyde de sodium Na2O
savon RCO2- + Na+ (ou K+)
5. Couples acide/base
Voir rabat de la couverture du livre pour une liste plus détaillée.
H3O+ / H2O
H2O / OH-
HCl / Cl-
NH4+ / NH3
H2O, CO2 / HCO3-
HNO3 / NO3-
HCO3- / CO32-
SO2,H2O / HSO3-
acide carboxylique / ion carboxylate RCO2H / RCO2
acide éthanoïque / ion éthanoate CH3CO2H / CH3CO2 -
6. Couples oxydant/réducteur
H+ / H2
O2/H2O
H2O2/H2O
cation métallique / métal Mn+/M
Fe3+ / Fe2+
I2 / I-
MnO4- / Mn2+
(ion dichromate / ion chrome) Cr2O72- / Cr3+
(ion tétrathionate / ion thiosulfate) S4O62- / S2O32-
C6H6O6/C6H8O6
7. Familles en chimie organique
Voir rabat de la couverture du livre pour une liste plus détaillée.
1
/
3
100%