Feuille VI-1 Chap. 6 : LES PRINCIPES ACTIFS DES

Feuille VI-1 Chap. 6 : LES PRINCIPES ACTIFS DES MEDICAMENTS DOCUMENTS
Doc. 1 : Dopamine et noradrénaline.
Doc. 2 : les gaz nobles et la classification périodique.
Dans la nature, les atomes restent rarement isolés à l’état d’atome ; ils forment, en général, des
édifices chimiques : molécules, ions ou métaux. Cependant, certains éléments ne forment pas
d’édifices chimiques et restent à l’état d’atome : on dit qu’ils sont chimiquement inertes.
C’est le cas de l’hélium He, du néon Ne, de l’argon Ar, du krypton Kr… Dans les conditions habituelles
de température et de pression, ce sont des gaz : les gaz nobles.
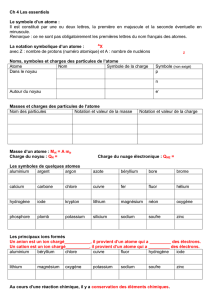
Hydrogène
1H
Hélium
2He
Lithium
3Li
Béryllium
4Be
Bore
5B
Carbone
6C
Azote
7N
Oxygène
8O
Fluor
9F
Néon
10Ne
Sodium
11Na
Magnésium
12Mg
Aluminium
13Al
Silicium
14Si
Phosphore
15P
Soufre
16S
Chlore
17Cl
Argon
18Ar
Potassium
19K
Calcium
20Ca
Gallium
31Ga
Germanium
32Ge
Arsenic
33As
Sélénium
34Se
Brome
35Br
Krypton
36Kr
1. Rappeler la définition d’une famille chimique, en citer 3 exemples. Quel point commun possèdent
les éléments d’une même famille chimique ?
2. Que signifie le terme « inerte » dans le langage courant ? A-t-il la même signification en chimie ?
3. Pourquoi a-t-on placé les gaz nobles dans une même colonne de la classification périodique ?
4. Donner la structure électronique des atomes de gaz nobles de numéros atomiques inférieurs à 18.
5. Donner le nombre d’électrons sur la couche externe de ces atomes.
Doc. 3 : Le dentifrice.
On utilisera la classification périodique donnée dans le doc. 2.
L’étiquette d’un dentifrice contient les informations suivantes : « La formule fluorée aide vos dents à se
recharger en fluor et en calcium. Ainsi, elle garantit à vos dents une meilleure protection contre les
caries, et préserve jour après jour leur capital calcium. Contient un dérivé fluoré : fluorure de sodium
0,32%. »
1. Le texte fait référence au fluor, au calcium et au sodium. Peut-on savoir s’il s’agit des atomes ou
des ions ?
2. Donner le numéro atomique et le symbole des atomes de fluor et de sodium. Déterminer la
structure électronique et le nombre d’électrons externes de ces deux atomes.
3. Déterminer la formule des ions monoatomiques formés à partir des atomes de fluor et de sodium.
4. On ne peut pas déterminer la structure électronique de l’atome de calcium par la méthode vue au
chapitre 1 car son numéro atomique est supérieur à 18. Peut-on déterminer tout de même le
nombre d’électrons externes de cet atome ?
5. Déterminer la formule de l’ion monoatomique formé à partir de l’atome de calcium.
La dopamine est un neurotransmetteur.
Dans le milieu hospitalier, elle utilisée
comme un tonique qui accélère le rythme
cardiaque. Elle permet de maintenir la
pression artérielle et le débit sanguin
dans certains cas d’état de choc.
La noradrénaline est un neurotransmetteur.
Son usage est réservée au milieu hospitalier
pour traiter les chutes tensionelles ou les
chocs anaphylactiques.
Fig. 1 : Extrait de la classification périodique des éléments

Doc. 4 : ion lithium, compléments alimentaires
Sur le site Internet www.santecheznous.com, on peut lire les informations suivantes à propos du
médicament PMS-lithium citrate :
« Le citrate de lithium appartient à la classe des médicaments appelés antimaniaques. Le lithium
s’utilise pour traiter les épisodes maniaques du trouble bipolaire. Les personnes atteintes du trouble
bipolaire l’utilisent pour prévenir les épisodes maniaques ou en réduire la fréquence. Il agit en modifiant
l’équilibre de certaines substances chimiques qui existent naturellement dans le cerveau.
Le lithium commence à agir en 5 à 7 jours, mais il est possible qu’il mette jusqu’à 3 semaines pour
maîtriser les symptômes maniaques (par ex. l’insomnie, le manque de discernement, l’hyperactivité, les
sentiments de grandeur, l’agressivité et parfois l’hostilité).(…) Chaque dose de 5 mL de sirop à saveur
de cerise contient 8 mmol d’ion lithium.
Ingrédients non-médicinaux : parahydroxybenzoate d’alcool, arôme artificiel de cerise, acide citrique,
glycérine, méthylparabène, propylène glycol, propylparabène, hydroxyde de sodium, acide
chlorhydrique pour équilibrer le pH et sorbitol.»
1. Dans le tableau périodique des éléments, chercher le symbole et le numéro atomique du lithium.
2. Déterminer la structure électronique de l’atome de lithium.
3. Déterminer la formule de l’ion lithium formé à partir de l’atome de lithium.
4. Calculer la concentration molaire des ions lithium dans ce médicament.
5. Quelle est l’utilité des « ingrédients non-médicinaux » ?
Doc. 5 : Protection nucléaire civile
L’Autorité de Sûreté nucléaire civile (ASN) propose des comprimés d’iodure de potassium aux
habitants résidant dans un rayon de 10 km autour des centrales nucléaires françaises. Ces comprimés
doivent être avalés en cas de fuite d’iode radioactif dans l’atmosphère. En effet, la glande thyroïde est
un organe qui a la capacité de fixer l’iode. La prise des comprimés permet de fixer de l’iode non
radioactif sur la thyroïde, à la place de l’iode radioactif comme l’isotope 131. L’iode présent dans les
comprimés est stable, il s’agit essentiellement de l’isotope 127. Le numéro atomique de l’iode est
Z = 53.
1. Déterminer la formule de l’ion iodure formé à partir d’un atome d’iode (de symbole I).
2. Déterminer la formule de l’ion potassium formé à partir d’un atome d’iode.
3. Indiquer la représentation symbolique des noyaux des isotopes de l’iode cités dans le texte, puis
préciser leur composition.
4. En quoi ces isotopes diffèrent-ils ?
1
/
2
100%