Compl\xE9mentsCHICK - Serveur de listes de Creteil

Historique
Le vecteur
Aedes albopictus est un moustique originaire d’Asie du Sud-est, il aurait été introduit à Madagascar lors des grandes migrations austronésiennes
en provenance d’Indonésie au Vième siècle de notre ère. (les œufs sont très résistants à la dessiccation)
Le virus
Arthropode Born virus (arbovirus) du groupe des alphavirus de la famille des Togaviridés.
On distingue deux souches, l’une africaine et l’autre asiatique.
Virus à ARN de polarité positive ( la traduction se fait directement dans le cytoplasme de la cellule hôte)
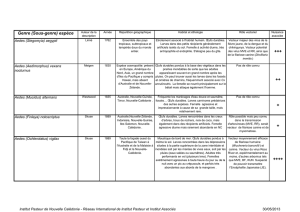
Lutte Mécanique :
Dans l’ile de la Réunion, la négligence des populations et la densification de l’habitat a permis la constitution d’une population d’Aedes
homogène sur le pourtour de l’ile.
La suppression des gites larvaires autour des maisons est un préalable à une lutte efficace contre le chikungunya et permettrait une fragmentation
des populations de moustiques.
De nombreuses arboviroses causées par des alphavirus sont présentes en Afrique :
Virus Mayaro
Virus O'Nyong-Nyong
Virus Sindbis
Fièvre jaune
Fièvre de la vallée du rift …
Lutte Chimique :
Elle est réalisée avec des organophosphorés : Le Fenitrothion, mortel pour les moustiques adultes et le Téméphos, mortel pour les larves, sont
utilisés par l'armée chez les particuliers, les agents de l'État dans les espaces et bâtiments publics - les établissements scolaires.
Mode d’action :
Les organophosphorés inhibent l'acétylcholinestérase.
L’AChE est impliquée dans les mécanismes de transmission de l'influx nerveux à travers l'organisme : dans les jonctions inter neuronales et
neuromusculaires, la terminaison nerveuse libère un médiateur chimique, l'acétylcholine (ACh), qui permet la transmission du message nerveux

d'une cellule à l'autre. Une fois l'information transmise, l'acétylcholine est rapidement inactivée par l'AChE, ce qui permet au système de revenir
à son état de repos. L'inhibition de l'enzyme par de nombreux neurotoxiques entraîne une accumulation du médiateur chimique dans l'espace
synaptique, qui maintient de ce fait une transmission permanente de l'influx nerveux, laquelle conduit généralement à la tétanie musculaire et à la
mort.
Le développement des organophosphorés en tant qu'insecticides date du début des années 1970, favorisé par l'interdiction d'utilisation des
composés organochlorés comme le DDT (dichloro-diphényl-trichloroéthane, hautement rémanent, dont le comportement lipophile en fait une
substance extrêmement bioaccumulable). Les organophosphorés s'imposent rapidement par une très grande efficacité, notamment contre les
insectes, et leur comportement dans l'environnement est considéré comme relativement inoffensif quand on les oppose aux organochlorés. Ceci
dit, ces molécules ne doivent en aucun cas être considérées comme étant écotoxicologiquement négligeables.
Résistance des moustiques aux insecticides : une même mutation commune à différentes espèces
La majorité des insecticides utilisés dans la lutte anti-vectorielle pour ralentir la transmission des maladies à l’homme sont des organophosphorés
et des carbamates qui inhibent une enzyme, l’acétylcholinestérase (AChE).
Or, depuis un certain nombre d’années, des résistances à ces pesticides dues à une modification de l'AChE apparaissent chez les moustiques.
Récemment, le gène d’acétylcholinestérase impliqué dans ces résistances a été identifié et nommé ace-1. Les chercheurs ont analysé sur ce gène
la nature des mutations responsables de la résistance chez Culex pipiens originaire de 10 pays d'Amérique, d'Europe et d'Afrique, et chez
Anopheles gambiae de Côte d'Ivoire.
Les résultats ont indiqué qu’une même mutation était présente dans le gène ace-1 des différentes espèces de moustique. Cette mutation
ponctuelle (correspondant au remplacement d’une base par une autre dans la chaîne ADN), conduit à la production d’une protéine dans laquelle
un acide aminé est remplacé par un autre (substitution de l’acide aminé glycine par une sérine : mutation G119S).
Des tests in vitro, réalisés sur des cellules en culture, ont confirmé que cette mutation était bien responsable de la résistance aux pesticides
employés (insensibilité au carbamate propoxur).
L'analyse approfondie du gène ace-1 a permis de voir que la mutation G119S s'était produite au moins à deux reprises différentes dans l'espèce
Culex pipiens. De plus, cette mutation ayant été retrouvée parmi la majorité des populations de moustiques couvrant le globe, il semble probable
que les chercheurs tiennent là une clé essentielle de l’origine des résistances des moustiques aux pesticides (voire d’autres résistances
de la part d’insectes différents comme les pucerons).
Est-ce que la pulvérisation des organophosphorés a un effet sur l'environnement?

Les organophosphorés se dégradent rapidement dans l'environnement, particulièrement dans le sol humide, et leur toxicité vis-à-vis des oiseaux
et des mammifères est faible.
Par contre ils sont très toxiques pour les insectes, y compris les insectes utiles, comme les abeilles.
Lutte biologique :
Elle est réalisée avec le Bacillus Thuringiensis Isralensis (B.T. I .) ou VECBAC.
Mode d’action :
Durant l'étape de sporulation de son cycle de vie, le Bti produit une protéine cristallisée, qui est toxique uniquement pour les larves de
moustiques et de mouches noires. Ces cristaux microscopiques sont ingérés par les larves des insectes lorsque celles-ci se nourrissent. Dans le
milieu alcalin de l'appareil digestif de ces insectes sensibles, les cristaux se dissolvent et se transforment en molécules protéiques toxiques qui
détruisent les parois de l'estomac. Les insectes cessent habituellement de se nourrir dans les heures qui suivent leur exposition au Bti et meurent
en quelques jours.
Quel effet le Bti a-t-il sur l'environnement?
Le Bti ne devient toxique qu'une fois rendu dans l'estomac des larves de moustiques ou de simulies. Le Bti n'a donc aucun effet sur les autres
insectes comme l'abeille domestique, ni sur les poissons, les oiseaux ou les mammifères. L’agence deprotection de l'Environnemental des États-
Unis estime que les risques présentés par les souches de Bti pour les organismes non visés sont négligeables à nuls. La toxine insecticide est en
outre rapidement biodégradée dans l'environnement par les rayons solaires et les microorganismes.
Comment peut-on lutter efficacement contre le CHICK et limiter ses effets sociaux et économiques tout en
préservant l’environnement ?
Diversité des moustiques du genre Aedes
Aedes abnormalis
Aedes cantator
Aedes fulvus
Aedes luteolateralis
Aedes phyllolabis
Aedes taeniorhynchoides
Aedes aboriginis
Aedes capensis
Aedes fulvus pallens
Aedes luteostriatus
Aedes pionips
Aedes taeniorhynchus

Aedes adami
Aedes carteri
Aedes fumidus
Aedes macfarlanei
Aedes pipersalatus
Aedes taeniorostris
Aedes adersi
Aedes cartroni
Aedes furcifer
Aedes
madagascarensis
Aedes pogonurus
Aedes tarsalis
Aedes aegypti
Aedes caspius
Aedes fuscinervis
Aedes mariae
Aedes polynesiensis
Aedes tauffliebi
Aedes aegypti formosus
Aedes cataphylla
Aedes gardnerii
Aedes marshallii
Aedes poweri
Aedes taylori
Aedes aerarius
Aedes chamboni
Aedes geniculatus
Aedes mascarensis
Aedes prominens
Aedes teesdalei
Aedes africanus
Aedes cinctus
holocinctus
Aedes gibbinsi
Aedes masoalensis
Aedes pseudoafricanus
Aedes telleri
Aedes aitkeni
Aedes cinereus
Aedes grahamii
Aedes mathioti
Aedes pseudotaeniatus
Aedes thelcter
Aedes albineus
Aedes circumluteolus
Aedes grassei
Aedes mattinglyi
Aedes pseudotarsalis
Aedes thibaulti
Aedes albocephalus
Aedes communis
Aedes grenieri
Aedes mediolineatus
Aedes pseudotarsalis
trifilatus
Aedes tiptoni
Aedes albodorsalis
Aedes congolensis
Aedes grjebinei
Aedes mediopunctatus
Aedes pubescens
Aedes togoi
Aedes albolineatus
Aedes contiguus
Aedes grossbecki
Aedes mefouensis
Aedes pulchrithorax
Aedes tricholabis
Aedes albopictus
Aedes cozi
Aedes hamoni
Aedes melanimon
Aedes pulcritarsis
Aedes tricholabis bwamba
Aedes alboscutellatus
Aedes crassiforceps
Aedes harrisoni
Aedes metallicus
Aedes pullatus
Aedes trichurus
Aedes albothorax
Aedes cretatus
Aedes hastatus
Aedes michaelikati
Aedes punctocostalis
Aedes triseriatus
Aedes alboventralis
Aedes culicinus
Aedes haworthi
Aedes microstictus
Aedes punctodes
Aedes trivittatus
Aedes alternans
Aedes cummensii
Aedes hebrideus
Aedes minutus
Aedes punctor
Aedes tulearensis
Aedes angustus
Aedes cumminsii
Aedes heischi
Aedes mitchellae
Aedes punctothoracis
Aedes uncus
Aedes annandalei
Aedes dalzieli
Aedes hexodontus
Aedes mixtus
Aedes quasirusticus
Aedes unilineatus
Aedes annulata
Aedes demeilloni
Aedes hirsutus
Aedes monetus
Aedes quasiunivittatus
Aedes varipalpus
Aedes annulipes
Aedes dendrophilus
Aedes holocinctus
Aedes monotrichus
Aedes reali
Aedes veeniae
Aedes apicoargenteus
Aedes dentatus
Aedes hopkinsi
Aedes moucheti
Aedes refiki
Aedes vexans
Aedes arborealis
Aedes detritus
Aedes hortator
Aedes mucidus
Aedes rickenbachi
Aedes vigilax
Aedes
argenteopunctatus
Aedes devisi
Aedes impiger
Aedes mutilus
Aedes riparius
Aedes vittatus
Aedes
argenteoventralis
Aedes dialloi
Aedes implicatus
Aedes natalensis
Aedes rossicus
Aedes vittiger
Aedes argyrothorax
Aedes diantaeus
Aedes imprimens
Aedes natronius
Aedes rusticus
Aedes wigglesworthi

Aedes atlanticus
Aedes domesticus
Aedes increpitus
Aedes neoafricanus
Aedes saxicola
Aedes woodi
Aedes atropalpus
Aedes dorsalis
Aedes ingrami
Aedes nigerrimus
Aedes scapularis
Aedes yangambiensis
Aedes aurifer
Aedes dufouri
Aedes insolens
Aedes nigricephalus
Aedes scatophagoides
Aedes yvonneae
Aedes axicola
Aedes durbanensis
Aedes interruptus
Aedes nigripes
Aedes scutellaris
Aedes zoosophus
Aedes bancoi
Aedes durhamii
Aedes irritans
Aedes nigromaculis
Aedes semlikiensis
Aedes barnardi
Aedes ebogoensis
Aedes jamoti
Aedes niphadopsis
Aedes septemstriatus
Aedes bequaerti
Aedes echinus
Aedes juppi
Aedes niveoides
Aedes serratus
Aedes bergerardi
Aedes edgari
Aedes kapretwae
Aedes notoscriptus
Aedes sierrensis
Aedes berlandi
Aedes ellinorae
Aedes kennethi
Aedes nyasae
Aedes simpsoni
Aedes bicristatus
Aedes embuensis
Aedes kummi
Aedes nyounae
Aedes simulans
Aedes biskraensis
Aedes eritreae
Aedes lamborni
Aedes ochraceus
Aedes soleatus
Aedes bolensis
Aedes eritreae
karooensis
Aedes langata
Aedes odantus
Aedes sollicitans
Aedes boneti
Aedes excrucians
Aedes laniger
Aedes oligopistus
Aedes spencerii
Aedes breedensis
Aedes falabreguesi
Aedes leesoni
Aedes opok
Aedes squamiger
Aedes brunhesi
Aedes filicis
Aedes leptolabis
Aedes orbitae
Aedes stanleyi
Aedes brygooi
Aedes fitchii
Aedes leucocelaenus
Aedes ovazzai
Aedes sticticus
Aedes caballus
Aedes flavescens
Aedes leucomelas
Aedes pachyurus
Aedes stimulans
Aedes caecus
Aedes flavimargo
Aedes lineatopennis
Aedes palpalis
Aedes stokesi
Aedes calceatus
Aedes fowleri
Aedes lineatus
Aedes pataigain
Aedes strelitziae
Aedes caliginosus
Aedes fraseri
Aedes longipalpis
Aedes pauliani
Aedes subargenteus
Aedes campestris
Aedes fryeri
Aedes longiseta
Aedes pembaensis
Aedes sudanensis
Aedes canadensis
Aedes fulgens
Aedes lottei
Aedes pernotatus
Aedes sylvaticus
Aedes cantans
Aedes fulvithorax
Aedes luteocephalus
Aedes phillipi
Aedes taeniarostris
1
/
5
100%