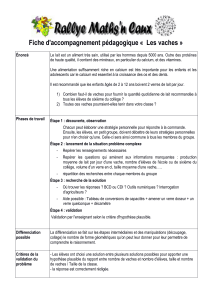
Devoir Maison n°1 : Composition d`un lait en poudre Voici les

Devoir Maison n°1 : Composition d’un lait en poudre
Voici les informations que l’on peut trouver sur l’étiquette d’un lait en poudre du commerce :
Exercice 1 : Le lactose
Le lactose est un glucide de formule brute C12H22O11. La quantité de matière de lactose présent dans 100g de lait en
poudre est de nlactose = 7,54.10-2 mol.
1) Calculer la masse molaire du lactose de deux façons.
2) Quel est le nombre N de molécules de lactose dans 100g de lait en poudre ?
3) En déduire la masse d'une molécule de lactose.
Exercice 2 : Le calcium
Le calcium est un élément essentiel à l’organisme qui se trouve en grande quantité dans le lait. Un atome de calcium
a pour numéro atomique Z = 20.
1) Combien d’électrons possède le calcium ? En déduire alors leur répartition dans les couches (K),(L) et (M).
2) Justifiez à l’aide de la règle de l’octet que l’ion stable du calcium est l’ion Ca2+. Combien de liaisons chimiques
peut-ainsi former l’élément calcium ?
3) L’isotope du calcium le plus répandu possède 20 neutrons. Calculer la masse d’un tel atome de calcium.
4) En admettant que seul cet isotope est présent dans le lait en poudre, combien d’atomes de calcium se trouvent
dans 100g de ce produit ?
5) En déduire la quantité de matière nCalcium correspondante.

Exercice 3 : Reconstitution du lait
1) Calculer pour les lipides le rapport entre la masse présente dans le lait reconstitué et la masse présente dans le
lait en poudre. En déduire alors pourquoi on parle de lait reconstitué à 13,5%.
2) Quelle masse d’eau et de poudre faut-il mélanger pour obtenir 100g de lait reconstitué ?
L’acide linoléique est un acide gras de formule brute C18H32O2.
3) Calculer la masse molaire de l’acide linoléique.
4) Quelle quantité de matière d’acide linoléique se trouve dans 100g de boisson ?
5) La densité de ce lait est de 1,032. En déduire le volume des 100g de boisson. Si vous ne savez pas prendre 100 mL
pour la suite.
6) Calculer alors la concentration molaire en acide linoléique de ce lait.
Exercice 4 : Le potassium
Le potassium est, tout comme le calcium, présent en grande quantité dans le lait.
1) Calculer en g/L la concentration massique du potassium dans le lait reconstitué.
2) Le potassium est l’élément qui se trouve juste avant le calcium dans le tableau périodique. En déduire alors son
numéro atomique en justifiant.
3) L’isotope le plus courant du potassium possède le même nombre de neutrons que celui du calcium. En déduire la
composition de son noyau.
4) Calculer alors la masse d’un atome de cet isotope et en déduire une valeur approchée de la masse molaire du
potassium.
5) Déduire de vos réponses aux questions 1 et 4 la concentration molaire en potassium de ce lait.
Exercice 5 : L’acide lactique
La teneur en acide lactique est un critère de fraîcheur et de qualité du lait. Si la teneur en acide lactique dépasse
5,0 g.L−1, le lait caille.
1) Calculer la masse molaire de l’acide lactique de formule C3H6O3.
2) La quantité de matière d’acide lactique dans un verre de lait reconstitué de volume 120 mL est de 4,0.10−3 mol. Ce
lait peut-il être considéré comme frais ?
Données :
Particule
Proton
neutron
électron
masse
- Le nombre d’Avogadro NA vaut 6,02.1023 mol-1, il y a donc 6,02.1023 atomes dans une mole d’atomes.
- La masse volumique de l’eau est de 1000 g.L-1
1
/
2
100%