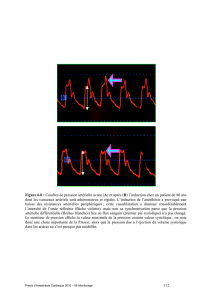
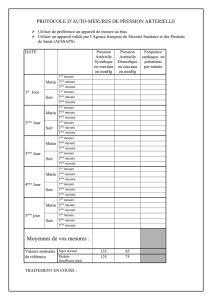
Lire l`article complet

Prise en charge initiale et au bloc opératoire d'un choc
hypovolémique
par C. Denantes*, D. Diango**, C.M. Samama*
* Médecin anesthésiste-réanimateur. Hôpital Avicenne, Bobigny, France.
** Médecin anesthésiste-réanimateur. Hôpital Nianankoro Fromba, Ségou, Mali.
L'état de choc est un état d'insuffisance circulatoire aigu caractérisé par une
diminution globale de la perfusion tissulaire compromettant l'apport en oxygène au
niveau cellulaire et se compliquant souvent de défaillances d'organes. Le tableau
associe à l'hypotension artérielle, une tachycardie et des signes d'altération de
perfusion des organes (vasoconstriction cutanée, troubles neuropsychiques...). Le
choc hypovolémique survient le plus souvent lors d'une hémorragie. C'est la
première cause de mortalité en traumatologie.
I. Physiopathologie
Le choc hypovolémique survient pour une diminution de la volémie de l'ordre de
30%. La baisse du volume sanguin entraîne une baisse du retour veineux. Il en
résulte une diminution des pressions de remplissage cardiaque et du volume
d'éjection systolique qui retentit sur le débit cardiaque et la pression artérielle
(tableau n° 1). Cette dernière est régulée par des mécanismes compensateurs
neurologiques et endocriniens auxquels se surajoutent des phénomènes
d'autorégulation des débits locaux.
Au cours du choc hémorragique, on distingue un stade précoce réversible avec une
phase initiale dite compensée où la tachycardie est isolée puis une phase secondaire
avec hypotension associée à une tachychardie ou plus rarement à une bradychardie
et un stade tardif décompensé et irréversible où le patient décède dans un tableau
de défaillance multiviscérale.
1. Phase précoce biphasique et réversible
Phase initiale dite compensée
La réponse principale, sympathomimétique, significative pour des pertes sanguines
supérieures à 10%, est la vasoconstriction périphérique compensatrice des territoires
muscuIo-cutanés, splanchniques et rénaux dont la finalité est de préserver la
perfusion des organes vitaux (coeur, cerveau, foie...) où le flux sanguin est modulé
par une autorégulation régionale dont l'élément déterminant est l'hypoxie. Les
catécholamines par leurs effets vasoconstricteurs maintiennent la pression artérielle
systémique durant la première phase dite compensée du choc où la tachycardie est
isolée. Les facteurs hormonaux sont peu impliqués à l'exception du système rénine

angiotensine avec l'angiotensine, qui provoque une vasoconstriction et une
augmentation de la contractilité myocardique.
Phase secondaire : syncope vasovagale
En cas d'hypovolémie massive, supérieure à 25% du volume sanguin, une
stimulation parasympathique par les mécano-récepteurs intracardiaques, dont la
finalité serait un meilleur remplissage ventriculaire diastolique, succède à la
stimulation sympathique. On peut observer une hypotension associée à une
bradycardie qui répond bien au remplissage.
2. Phase tardive, décompensée et irréversible
La pérennisation de l'ischémie, est à l'origine de modifications microcirculatoires, et
d'une fuite plasmatique capillaire vers le secteur interstitiel. L'hypoxie tissulaire, qui
oriente les cellules vers un métabolisme anaérobie avec acidose métabolique,
entraîne une défaillance multiviscérale (myocardique, rénale, respiratoire,
neuropsychique, hépato-splanchnique).
3. Conséquences pharmacologiques
La réduction du débit sanguin rénal et du débit sanguin hépatique, ainsi que l'acidose
modifient le métabolisme hépatique et l'élimination rénale des agents anesthésiques.
Une réduction des doses, en particulier des hypnotiques, semble nécessaire.
Il. Etiologies de l'état de choc hypovolémique
1. Les hypovolémies non hémorragiques
Elles sont liées à des pertes hydrosodées d'origine digestive, rénale ou cutanée. Les
affections digestives sont les plus fréquentes avec les vomissements et les
diarrhées. Les pertes rénales viennent ensuite avec certaines néphropathies, les
polyuries osmotiques et les déficits en minéralocorticoïdes. Les pertes cutanées des
brûlures étendues qui s'accompagnent d'une déperdition protidique majeure sont la
troisième cause. Nous excluons les hypovolémies relatives secondaires à une
intense vasodilatation, parfois associée à une fuite plasmatique comme dans les
chocs allergique et septique.
2. Les hypovolémies hémorragiques
L'hémorragie, le plus souvent traumatique, peut-être externe (plaie vasculaire, plaie
du cuir chevelu, épistaxis) ou interne (hémothorax, hémopéritoine, hématome rétro-
péritonéal). Hors d'un contexte traumatique elle est, le plus souvent, interne
(saignement digestif, gynéco-obstétrical ou vasculaire).
III. Diagnostic clinique et paraclinique
1. Aspects cliniques

Le tableau associe à l'hypotension des signes d'altération de perfusion des organes.
Le diagnostic est affirmé devant :
- une pression artérielle systolique inférieure à 90 avec un pincement de la
différentielle ou effondrée voire imprenable ;
- une tachycardie sinusale (> 90 battements/mn) avec un pouls rapide, filant et
difficilement prenable ;
- des troubles neuropsychiques qui peuvent aller de la simple somnolence à la
confusion avec agitation, angoisse, voire au coma ;
- une vasoconstriction cutanée, caractérisée par la pâleur des téguments et des
muqueuses, des marbrures initialement limitées aux genoux puis s'étendant aux
cuisses et à l'abdomen, une froideur et une cyanose des extrémités, un temps de
recoloration capillaire supérieur à 2 secondes ;
- une tachypnée supérieure à 20 cycles par mn ;
- une soif intense et une oligurie inférieure à 20 ml/h ou 0,5 ml/kg/h, constante mais
difficile à évaluer dans un contexte d'urgence et évoluant rapidement vers une
anurie;
- la mise en évidence de l'origine du saignement qui dépend des circonstances de
survenue (contexte traumatique ou non traumatique).
Le danger majeur est de sous-estimer une hypovolémie et de négliger sa prise en
charge. La pression artérielle systolique est maintenue, de façon initiale, du fait de la
réaction adrénergique et l'hypotension n'est démasquée que pour une hypovolémie
de plus 30% de la masse sanguine. L'absence d'hypotension artérielle, de
tachycardie voire une bradycardie paradoxale ou la présence prédominante de
manifestations neuropsychiques peuvent conduire à tort à rejeter le diagnostic.
2. Examens paracliniques
Aucun examen paraclinique n'est nécessaire au diagnostic d'état de choc. Les
examens complémentaires permettent d'établir l'importance du saignement, le
retentissement de l'insuffisance circulatoire sur les différents organes et le
mécanisme.
Deux prélèvements sanguins de référence signalés « urgent »
- La Numération Formule Sanguine (NFS). Le taux d'hémoglobine et le taux
d'hématocrite sont de mauvais indices de l'hémorragie à la phase précoce,
l'hémodilution n'intervient que secondairement, et ils doivent être interprétés selon
l'expansion volémique associée.
- Le groupage sanguin ABO et rhésus et la Recherche d'Agglutinines Irrégulières
(RAI).

Autres examens en fonction des circonstances
La mise en condition initiale est entreprise immédiatement et le choix des examens
complémentaires est conditionné par la réponse à cette mise en condition de l'état de
choc et par le plateau technique (laboratoire, matériel de radiologie).
- Les examens biologiques associent un bilan hématologique à la recherche de
troubles de l'hémostase (plaquettes, TP-TCA, fibrinogène et facteurs de la
coagulation), un bilan rénal à la recherche de troubles hydroélectrolytiques en
rapport avec une insuffisance rénale ou une rhabdomyolyse (Na, K, urée et
créatinine, CPK et myoglobine) ; des gaz du sang et des lactates artériels à la
recherche d'une hypoxie tissulaire qui se traduit par le développement d'un
métabolisme anaérobie.
- Les 3 examens radiologiques, que l'on peut avoir d'emblée, sont un cliché du thorax
de face, un abdomen sans préparation (ASP) à défaut d'un examen échographique
de l'abdomen (ou d'une ponction lavage péritonéale) et un bassin de face à défaut
d'un scanner.
IV. Prise en charge
Le traitement symptomatique d'un état de choc comporte plusieurs mesures qui
doivent être entreprises simultanément pour maintenir la volémie, le transport de
l'oxygène, l'hémostase et prévenir les complications.
1. Geste d'hémostase d'urgence
C'est un geste à faire sans délai pour arrêter la cause du saignement : compression
ou clampage chirurgical d'une lésion vasculaire, voire pose d'un garrot en ultime
recours, suture d'une plaie du cuir chevelu, tamponnement d'un épistaxis. Hors d'un
contexte traumatique, certains gestes d'hémostase peuvent être effectués : mise en
place d'une sonde de Blackmore (hémorragie digestive), tamponnement vaginal
(hémorragie vaginale), surélévation d'un membre inférieur (plaie veineuse ou rupture
de varice).
2. Oxygénothérapie et ventilation
Une oxygénation doit être systématique car le transport d'oxygène est diminué par la
chute du taux d'hémoglobine. Elle est réalisée par une sonde nasale, un masque à
haute concentration d'oxygène, une intubation avec ventilation assistée en cas de
détresse respiratoire ou neurologique (score de Glasgow < 9), ou d'intervention
chirurgicale. La ventilation assistée peut avoir des effets délétères sur
l'hémodynamique en diminuant le retour veineux.
3. Voies d'abord
Poser 2 voies veineuses périphériques de fort calibre (14-16 G). Une voie veineuse
centrale n'est pas posée de 1e intention mais en cas de nécessité un cathéter de
gros calibre (8 à 10 French) peut-être mis en place en privilégiant la voie fémorale
plus rapidement accessible et moins dangereuse que les voies sous-clavière et

jugulaire. Des systèmes de perfusion sont installés dont le débit est adapté au
saignement : tubulures standards (120 ml/mn), tubulures à compression manuelle
type "Blood pump", (200 ml/mn), poches de contre-pression pneumatiques,
accélérateurs de solutés (500 ml/mn), tubulures à sang. Au système de perfusion
devrait être associé un réchauffeur.
4. Demande de produits sanguins (CG, plaquettes et plasma)
Dès l'arrivée d'un patient en état de choc hémorragique, une demande de produits
sanguins avec un délai de délivrance est faite (tableau n° 2) : procédure de demande
de produits sanguins en cas d'urgence vitale. En l'absence de banque du sang, il faut
rechercher, prélever et grouper des donneurs volontaires et bénévoles qui peuvent
être des parents.
5. Remplissage
L'expansion volémique est la base du traitement pour maintenir la perfusion des
organes et le retour veineux.
Un test de remplissage Initial
La réponse au remplissage initial, qui confirme à posteriori l'hypovolémie, s'apprécie
sur des critères cliniques d'efficacité tels que la correction de la tachycardie,
l'élévation de la pression artérielle systolique et sur des critères de tolérance tels que
l'apparition d'un œdème pulmonaire. En cas d'hypovolémie non hémorragique, le
volume à perfuser est de 20 ml/kg de poids en 15 mn que l'on peut renouveler une
fois si besoin.
Objectif du remplissage
L'objectif est d'assurer la survie du patient jusqu’à l'hémostase définitive et d'éviter
les complications du choc hémorragique que sont les défaillances d'organes. La
normalisation de la pression artérielle systolique n'est pas un but en soi. Le niveau à
atteindre dépend du type de pathologie.
- En cas de traumatisme crânien ou de traumatisme médullaire, il faut éviter
l'hypotension source d'aggravation neurologique. L'objectif de pression artérielle
systolique à obtenir est à 110-120 mmHg.
- En cas d'hémorragie par lésion viscérale ou vasculaire, une hypotension artérielle
relative est tolérée pour ne pas majorer le saignement dans l'attente de l'hémostase.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
1
/
13
100%