quel objectif therapeutique hemodynamique faut-il se

QUEL OBJECTIF THERAPEUTIQUE HEMODYNAMIQUE FAUT-IL SE DONNER?
431
QUEL OBJECTIF THERAPEUTIQUE
HEMODYNAMIQUE FAUT-IL SE DONNER
CHEZ LE POLYTRAUMATISE
N. Smail, Département d’Anesthésie-Réanimation de Bicêtre, Hôpital de Bicêtre,
78 rue du Général Leclerc, 94275 Le Kremlin-Bicêtre.
INTRODUCTION
Alors que la plupart des équipes s’accordent à dire que la prise en charge des
patients polytraumatisés requiert une structure adaptée à cet usage et une équipe de
spécialistes rodée à l’accueil de tels patients, le traitement initial des patients polytrau-
matisés n’est toujours pas standardisé en raison de la persistance de nombreux sujets
de controverse. S’il est certain que l’utilisation de protocole de prise en charge
«pré-établi» et l’expérience de l’équipe d’accueil dans la prise en charge des polytrau-
matisés permet de diminuer le nombre de décès, l’extrême diversité des patients, des
mécanismes lésionnels et des lésions traumatiques rencontrées rend très difficile tout
protocole visant à comparer différentes options thérapeutiques. La littérature ne four-
nissant pas de directives précises et/ou objectives concernant les buts thérapeutiques à
atteindre lors de la réanimation des polytraumatisés, les recommandations qui suivent
reposent sur le savoir faire et la réflexion de notre équipe, spécialisée dans l’accueil des
patients polytraumatisés depuis 1984.
1. PROFIL HEMODYNAMIQUE
En dehors des situations cliniques où le patient traumatisé est normotendu ou stable
sur le plan hémodynamique et dans lesquelles la réanimation ne pose que peu ou pas de
problèmes, le traumatisme sévère s’accompagne fréquemment d’une hypotension arté-
rielle dont l’origine peut-être multifactorielle (Figure 1).
L’hypotension artérielle post-traumatique résulte d’une hypovolémie vraie (pertes
hémorragiques) et d’une hypovolémie relative (vasoplégie d’origine neurologique ou
inflammatoire) éventuellement aggravée par l’administration d’agents anesthésiques [1].
Dans 20 % des cas cependant, l’hypotension artérielle peut également avoir une com-
posante obstructive [2]. La méconnaissance de ce diagnostic peut conduire à un décès
rapide en l’absence de traitement spécifique. Il s’agit le plus souvent de pneumothorax
compressif (exsuflation et/ou drainage pleural), beaucoup plus rarement de tampon-
nade cardiaque (drainage péricardique).

MAPAR 2000432
Il n’existe pas, chez l’homme, de données concernant l’état hémodynamique de
patients polytraumatisés non réanimés. Des explorations hémodynamiques (échocar-
diographie et cathétérisme cardiaque droit) réalisées dès l’admission du patient en salle
de réveil ont mis en évidence un tableau de choc hyperkinétique (augmentation
du débit cardiaque, pression artérielle normale ou basse et résistances vasculaires
normales ou abaissées) [3, 4].
D’autres études publiées rapportent des résultats similaires [5, 6]. D’autre part, l’ex-
ploration échocardiographique retrouvait une altération transitoire et modérée de la
contractilité cardiaque (normalisation spontanée de la contractilité en 24 à 48 heures)
sans arguments échographiques en faveur d’une hypovolémie (probablement déjà com-
pensée par l’administration pré-hospitalière de remplissage vasculaire) [4].
Ce tableau hémodynamique concorde avec le résultat des expérimentations anima-
les menées afin d’élucider la physiopathologie du choc post-traumatique [1, 6-9]. Ces
études ont montré que les lésions traumatiques entraînent la libération de nombreux
médiateurs qui provoquent en quelques heures une réaction inflammatoire systémique.
La plupart de ces médiateurs proviennent de l’activation de la coagulation, de l’immu-
nité humorale et cellulaire. L’activation des macrophages et des polynucléaires
neutrophiles provoque la libération d’autres médiateurs (radicaux libres de l’oxygène,
proteïnase, eicosanoïdes, PAF,...) responsables de lésions endothéliales sévères
aboutissant à l’œdème des cellules endothéliales et à l’augmentation de la perméabilité
capillaire [7-9].
Par ailleurs, plusieurs études ont rapporté l’existence d’un facteur dépresseur myo-
cardique libéré par les cellules pancréatiques ischémiques, responsable d’un effet
inotrope négatif par blocage du calcium dans le couplage excitation-contraction. Il existe
enfin une altération précoce de la contraction et de la relaxation vasculaire non corrigée
par la réanimation et susceptible d’expliquer la persistance de l’hypotension artérielle
malgré la correction de l’hypovolémie [10].
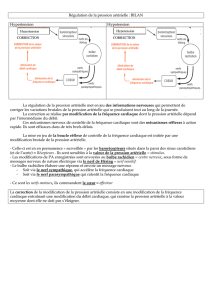
2. OBJECTIFS THERAPEUTIQUES HEMODYNAMIQUES
Les objectifs thérapeutiques guident la prise en charge initiale. Les buts de cette
première période sont d’éviter les décès immédiats (par exsanguination ou par surve-
nue d’une mort encéphalique) et de prévenir les complications secondaires (également
responsables de décès à une phase plus tardive ou de séquelles graves).
Figure 1 : Orientations diagnostiques devant une hypotension arterielle post-
traumatique
Hypotension Obstructive
Hypololémie
vraie
Hypovolémie
relative
Pertes hémorragiques
Vasoplégie
Neurologique Inflammatoire

QUEL OBJECTIF THERAPEUTIQUE HEMODYNAMIQUE FAUT-IL SE DONNER?
433
2.1. SYNDROME HEMORRAGIQUE CLINIQUE
L’existence d’une hémorragie extériorisée doit conduire à un geste d’hémostase
immédiat (compression puis chirurgie). On se méfiera tout particulièrement des plaies
du cuir chevelu (qui doivent être suturées en urgence) et des épistaxis (qui nécessitent
parfois un geste d’artério-embolisation) dont l’abondance du saignement est souvent
sous-estimée.
Lorsqu’aucune source de saignement n’est évidente, l’hypotension hémorragique
est liée à 3 causes : hémopéritoine, hémothorax ou hématome rétropéritonéal. Trois
examens suffisent donc pour faire le diagnostic de la lésion hémorragique (radio-
graphie du thorax, du bassin et échographie abdominale). Ainsi, la mise en évidence
d’une fracture du bassin même mineure chez un patient instable sur le plan hémodyna-
mique et qui ne présente pas d’hémopéritoine ou d’hémothorax abondants doit conduire
à un geste d’artério-embolisation en urgence.
L’administration d’une expansion volémique massive, avant contrôle de la lésion
hémorragique, pourrait majorer les pertes sanguines par restauration des paramètres
hémodynamiques et dilution des facteurs de la coagulation, et s’avérer, ainsi, être
délétère [11].
Ainsi chez ces patients, le maintien de la PAM à 60-70 mmHg paraît raisonnable
tant qu’il n’existe pas de signes de mauvaise tolérance hémodynamique (persistance de
l’acidose lactique, oligo-anurie avec ou sans insuffisance rénale associée, persistance
d’une tachycardie importante, insuffisance coronarienne).
2.2. HYPERTENSION INTRACRANIENNE
L’objectif chez ces patients est d’éviter le passage en mort cérébrale et de limiter les
lésions neurologiques secondaires qui viendront alourdir le pronostic fonctionnel à long
terme.
Le traitement de ces patients visera tout particulièrement à augmenter la PAM par le
remplissage et l’administration de vasopresseurs de façon à maintenir la pression de
perfusion cérébrale > 70 mmHg. Le niveau de pression artérielle sera adapté en fonc-
tion des vélocités dans les artères cérébrales moyennes (vélocités diastoliques > 30) et
de la saturation veineuse en oxygène dans la veine jugulaire (idéalement > 70 %).
De même tous les facteurs susceptibles de venir compromettre l’hémodynamique céré-
brale doivent être contrôlés (maintien de l’osmolarité plasmatique, de la capnie entre
35 et 40 mmHg, lutte contre l’hypoxie et l’hyperthermie). Le monitorage de ces pa-
tients nécessite la mise en place d’une pression artérielle invasive, la surveillance de la
SaO2, de l’etCO2 et de la température. Un capteur de pression intra-crânienne [12] et un
cathéter permettant la surveillance de la saturation veineuse en oxygène dans la veine
jugulaire seront mis en place dès que possible.
2.3. DEFAILLANCE MULTIVISCERALE
La littérature, abondante dans ce domaine, ne fournit pas de directives claires ou
directement applicables chez le patient pour réduire l’incidence des défaillances multi-
viscérales post-traumatiques : restauration de la normovolémie, restauration du volume
interstitiel, normalisation du transport en oxygène et du métabolisme cellulaire…
La restauration rapide d’une pression de perfusion tissulaire adéquate semble
prévenir le syndrome de défaillance multiviscérale. Cependant la normalisation de cer-
tains paramètres hémodynamiques comme le débit cardiaque ne permet pas, chez
l’animal, de rétablir une perfusion tissulaire normale au sein de nombreux tissus (terri-
toire splanchnique, rein, peau, muscle) [13-14].

MAPAR 2000434
C’est pourquoi de nombreux auteurs recommandent encore l’administration d’un
remplissage vasculaire massif, voire l’obtention de valeurs hémodynamiques supra-
normales afin de limiter les risques d’ischémie tissulaire [15-16]. Des études plus récentes
rapportent cependant une aggravation de la morbidité et de la mortalité, chez les pa-
tients réanimés de façon à atteindre ces buts thérapeutiques [17-18]. De même, les études
cliniques réalisées dans le service ont montré que l’expansion volémique massive était
un critère prédictif de survenue de syndrome de défaillance multiviscérale [19] et que
la réduction du remplissage vasculaire initial par l’administration précoce de vasopres-
seur permettait de diminuer la morbidité post-traumatique et de réduire la durée de
séjour en réanimation [20].
2.4. EN PRATIQUE
L’hypotension artérielle post-traumatique étant liée à une hypovolémie vraie (per-
tes sanguines) et relative (vasoplégie d’origine neurologique ou inflammatoire), son
traitement logique associe donc l’administration de remplissage vasculaire, de vaso-
presseurs et l’hémostase chirurgicale ou l’embolisation de la lésion responsable de l’hé-
morragie (Figure 2).
Nous administrons des vasopresseurs dès que la PAS reste < 80 mmHg après 500 mL
de remplissage. A ce stade très précoce, la dopamine est la plus souvent utilisée, à la
dose de 10 µg.kg-1.min-1 en raison de sa mauvaise tolérance en cas d’hypovolémie as-
sociée (apparition d’une tachycardie délétère qui sera corrigée par un arrêt transitoire
de la perfusion de dopamine et par le remplissage vasculaire). La dopamine et le rem-
plissage vasculaire sont ensuite administrés de façon à maintenir la PAS ≥80 à 90 mmHg
Figure 2 : Prise en charge thérapeutique des hypotensions artérielles post-
traumatiques.
Hypotension Obstructive
Hypololémie
vraie
Hypovolémie
relative
Pertes hémorragiques
Vasoplégie
Neurologique Inflammatoire
Drainage
pleural
péricardique
Vasopresseurs
Dopamine 10 µg.kg-1.min-1
Hémostase chirurgicale
remplissage QSP pour
PAS ≥ 90 mmHg*
* en l’absence d’hypertension intracrânienne associée

QUEL OBJECTIF THERAPEUTIQUE HEMODYNAMIQUE FAUT-IL SE DONNER?
435
tant qu’il n’existe pas de signes de mauvaise tolérance hémodynamique (persistance
d’une tachycardie importante, oligo-anurie, acidose lactique, ischémie myocardique).
La persistance d’une hypotension artérielle impose la mise en place d’un monitorage
hémodynamique. L’échocardiographie transœsophagienne (ETO) est l’examen de choix
car il est peu invasif et facilement réalisable sans interférer avec la prise en charge du
patient. Elle permet l’évaluation en temps réel des performances cardiaques, aide au
diagnostic d’hypovolémie par la mesure des surfaces télédiastolique et télésystolique du
VG [21] et permet d’éliminer une composante obstructive à l’hypotension artérielle.
Elle complète enfin le bilan lésionnel (recherche de lésion vasculaire aortique). A dé-
faut, la mise en place d’un cathéter de Swan-ganz donne accès à la mesure du débit
cardiaque et des pressions de remplissage et permet d’ajuster la thérapeutique (remplis-
sage vasculaire, augmentation des vasopresseurs, adjonction d’inotropes positifs).
CONCLUSION
Le polytraumatisé grave présente fréquemment une hypotension artérielle d’origine
mixte
, hypovolémique et vasoplégique. Le traitement précoce de la composante vaso-
plégique de l’hypotension artérielle post-traumatique permet d’ajuster le remplissage
vasculaire et diminue la morbidité liée au traumatisme sévère. En l’absence d’études
évaluant les paramètres hémodynamiques optimum, c’est la tolérance clinique qui fixe
la valeur des objectifs hémodynamiques thérapeutiques à atteindre.
REFERENCES BIBLIOGRAPHIQUES
[1] Demling R, LaLonde C, Saldinger P, Knox J. Multiple-organ dysfunction in the surgical patient:
pathophysiology, prevention, and treatment. Curr Probl Surg 1993;30:345-414
[2] Van Niekerk J, Goris RJA. Management of the trauma patient. Clin Intens care 1990;1:32-6
[3] Moore FA, Haenel JB, Moore EE, Witehill TA. Incommensurate oxygen consumption in response to
maximal oxygen availability predicts postinjury multiple organ failure. J Trauma 1992;33:58-67
[4] Smail N, Descorps-Declère A, Duranteau J, Vigue B, Samii K. Left ventricular function after severe
trauma. Intensive Care Med 1996;22:439-42
[5] Bishop MH, Shoemaker WC, Appel PL, Wo CJ, Zwick C, Kram HB, Meade P, Kennedy F, Fleming AW.
Relationship between supranormal circulatory values, time delays, and outcome in severely traumatized
patients. Crit Care Med 1993;21:56-63
[6] Sturm JA, Lewis FR, Jr, Trentz O, Oestern HJ, Hempelman G, Tscherne H. Cardiopulmonary
parameters and prognosis after severe multiple trauma. J Trauma 1979;19:305-18
[7] Schlag G, Redl H. Mediators in trauma. Acta Anaesthesiol Belg 1987; 38: 281-91
[8] Schlag G, Redl H, Hallstrom S.The cell in shock: the origin of multiple organ failure. Resuscitation
1991;21:137-80
[9] Barroso-Aranda J, Schmid-Schonbein GW, Zweifach BW, Engler RL. Granulocytes and no-reflow
phenomenon in irreversible hemorrhagic shock. Circ Res 1988;63:437-47
[10] Wang P, Ba ZF, Chaudry IH. Endothelial cell dysfunction occurs after hemorrhage in nonheparinized
but not in preheparinized models. J Surg Res 1993;54:499-506
[11] Bickell WH, Wall MJ, Jr, Pepe PE, Martin RR, Ginger VF, Allen MK, Mattox KL. Immediate versus
delayed fluid resuscitation for hypotensive patients with penetrating torso injuries. N Engl J Med
1994;331:1105-9
[12] Recommandations pour la pratique clinique. Prise en charge des traumatisés crâniens graves à la
phase précoce. Ann Fr Anesth Réanim 1997;18:1-172
[13] Smail N, Wang P, Cioffi WG, Bland KI, Chaudry IH. Resuscitation after uncontrolled venous
hemorrhage: Does increased resuscitation volume improve regional perfusion? J Trauma 1998;44:701-8
 6
6
1
/
6
100%