Physique

Physique Monsieur FAYNOT Philippe
Les commentaires publiés les années précédentes sont plus que jamais d’actualité. Nous
n’avons pas souhaité ici faire un « copier coller ». Le lecteur est prié de s’y reporter. Nous
proposons ici un strict commentaire de l’épreuve de Physique (parties I & II) 2004.
– PARTIE I –
A – QUARTZ PIEZO-ÉLECTRIQUE
A.1 Impédance complexe
Sur la plupart des copies, l’impédance complexe ZAB, imaginaire pur, est correctement
définie. Mais les calculs se compliquent rapidement, surtout si le terme C, conservé, n’est pas
exprimé en fonction de a et Co, contrairement aux consignes de l’énoncé.
A.2 Module d’impédance
On oublie que Z est une valeur absolue et/ou on présente le résultat sous la forme d’une
expression à « quatre étages », difficilement exploitable par la suite.
A.3 Phase
Sur de très rares copies, les candidats recherchent les domaines de correspondant aux
signes de = Arg(ZAB). Mais, en général, le signe de cet argument n’est pas discuté, et la
valeur de la phase = + /2 est le seul résultat proposé.
A.4 Etude de Z
Le respect des consignes (cf. § A.1) permet d’aboutir à une expression relativement simple de
l’impédance Z.
A.5 Allure du graphe Z()
On retrouve, malheureusement, des valeurs de Z négatives, un point anguleux en 1 souvent
« arrondi », des valeurs finies en = 0 et = 2, etc.
A.6 Comportements particuliers
On attendait les comportements d’interrupteur fermé (ou « court-circuit ») pour = 1
(Z nul) et interrupteur ouvert pour = 2 (Z infini).
B – VAPORISATION DE L’EAU À TEMPÉRATURE AMBIANTE
B.1 Evaporation & pression de vapeur saturante de l’eau
La pression de vapeur saturante P*H2O(T) est la pression de l’équilibre L-V du corps pur eau,
à une température T donnée. Elle est aussi la valeur maximale de la pression partielle pH2O de
la vapeur qui surmonte le corps pur liquide : pH2O
P*H2O(T) à cette température.
Les circonstances du changement d’état « vaporisation » L
V sont diverses (vaporisation
dans le vide, vaporisation en atmosphère limitée, évaporation, ébullition, etc.).
- 8 -

L’évaporation de l’eau est le changement de phase L
V qui se manifeste lorsque la vapeur
d’eau participe à un mélange gazeux surmontant le liquide (atmosphère le plus souvent) et à
la condition que pH2O
P*H2O(T). Ce phénomène, qui se déroule lentement, est d’autant plus
facilité que l’atmosphère est renouvelée.
L’évaporation (séchage du linge, par exemple) peut intervenir, comme chacun sait, à
température ambiante (25 °C par exemple) à la condition que pH2O
P*H2O(). Lorsque
l’égalité pH2O = P*H2O() est vérifiée, le processus s’arrête. L’évaporation ne requiert donc
pas une température de 100 °C !
Les réponses sont généralement fausses, surprenantes et irrationnelles : P*H2O(T) apparaît trop
souvent comme la « force motrice » du phénomène ! Force est de constater que les étudiants
ne se sont jamais penchés sur ces questions…
B.2 Grandeurs thermodynamiques
Le diagramme de changement d’état du corps pur P = f(T) ne sert malheureusement jamais de
support à la réflexion. Les courbes permettent pourtant de constater que P* est une fonction
croissante de T.
L’ébullition intervient, comme son nom l’indique, à grand renfort de bulles, et à deux
conditions : que l’atmosphère qui surmonte le liquide eau ne contienne que de la vapeur d’eau
et que pH2O soit inférieure à P*. L’ébullition est une réponse rapide du système à une
perturbation (une très légère diminution de pression partielle, à T constante, suffit) ; le
phénomène cesse lorsque le système retrouve l’équilibre pour lequel l’égalité stricte
pH2O = P*H2O(T) est vérifiée. Un corps pur peut donc bouillir à toute température !
Au vu des chiffres, P* = 2300 Pa est souvent considérée, à tort, comme une pression
supérieure à la pression atmosphérique !
Les grandeurs thermodynamiques sont généralement bien définies et calculées, même si,
parfois, les propriétés des gaz parfaits (
H = n cp,m
T ou
U = n cv,m
T) sont appliquées
(à tort bien sûr) au système diphasé du corps pur. Notons que l’unité de la variation
d’entropie
S s’exprime en J K-1 (et non en J).
Tout transfert de chaleur, entre des points à des températures différentes, est créateur
d’entropie (Sc
0) : pour que la vaporisation soit réversible, il est nécessaire que T1 = Text.
B.3 Formule de Clapeyron
Si cette formule est souvent donnée, les grandeurs et les unités ne sont pas toujours
identifiées : P ou P* ? Vv ou uv ? v ou uv ? grandeurs massiques ou grandeurs molaires ? La
recherche de l’homogénéité de la formule (équation aux dimensions ou aux unités) rend
parfois bien des services !
B.4 Pression P*(323 K)
Echec traditionnel de l’intégration… Oubli de la constante dans la recherche de la primitive,
intégration sans bornes… Erreurs récurrentes. Peu d’étudiants aboutissent.
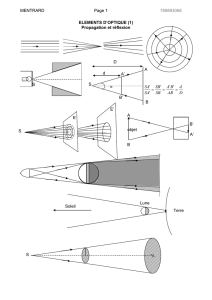
C – ETUDE D’UN DOUBLEUR DE FOCALE
C.1 Formule de conjugaison
Les erreurs sont très fréquentes sur les signes des grandeurs : il est impossible de traiter
l’optique géométrique avec des valeurs arithmétiques ou non algébriques. Il est rappelé que la
formule de conjugaison de Newton, avec origine aux foyers est parfois très pratique.
C.2 Calcul de d
La résolution de l’équation du second degré en d est rarement menée à son terme : défaillance
d’un outil mathématique de première nécessité ! - 9 -

C.3 Calcul de la taille h’
La relation du grandissement manque de maîtrise.
C.4 Doubleur de focale
La bonne résolution de cette question dépend de la construction des rayons : l’objet A’B’ est
un objet virtuel, donc situé en arrière de la lentille divergente, dans l’espace objet virtuel de
ce système optique. Il est donc impératif que le tracé des images et des rayons soit maîtrisé
pour une poursuite, sans encombres, du raisonnement !
C.5 Grandissement apporté par le doubleur de focale
Les candidats, dans cette partie, s’immergent dans un imbroglio numérique dont ils ne
ressortent jamais, même avec parfois la manipulation peu honnête des signes.
C.6-7 Mise au point, avec le doubleur de focale
Questions peu abordées : les candidats ne voient pas facilement qu’une grande précision sur
les valeurs est recherchée, dans le but de justifier le calcul.
C.8 Intérêt du doubleur de focale
On en reste aux déclarations percutantes : « comme le dit son nom, le doubleur de focale
double la focale »…
Quelques rares réponses plus évoluées permettent de conclure sur l’augmentation de la taille
(x 2) de l’image, sans que jamais personne ne pense au gain d’encombrement !
– PARTIE II –
A – ETUDE DE QUELQUES FIGURES DE DIFFRACTION
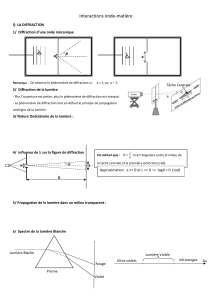
A.I.1 Phénomène de diffraction dans la vie courante
C’est le moment de détente pour les correcteurs… Il est exclu de rendre compte ici des
élucubrations retrouvées sur les copies. Retenons que la confusion entre diffraction et
réfraction est malheureusement générale. Signalons cependant que l’expérience de la
diffraction du pinceau laser par une fente fine n’est pas une expérience de la vie courante !
Ajoutons que la diffraction de la lumière se situe au niveau de pupilles ou d’objets de faibles
dimensions.
A.I.2 Trajet des rayons
On retrouve, ici, les faiblesses et les lacunes dans le domaine de l’optique géométrique citées
plus haut : les bases ne sont pas du tout maîtrisées !
A.I.3 Caractéristique de l’onde incidente
Peu de candidats pensent à la planéité de l’onde.
A.I.4 Quantité (M)
Le nom de cette quantité, parfaitement définie dans l’énoncé, est souvent ignoré. (M) est une
différence de marche, mais pas un chemin optique ou un vecteur d’onde…
- 10 -

A.I.5 Expression de la phase (M)
Cette question est bien traitée, encore faut-il savoir calculer le produit scalaire de deux
vecteurs…
A.I.6 Symétrie du phénomène de diffraction
Il est demandé de proposer un exemple de pupille admettant le point O comme centre de
symétrie. La question reste souvent sans réponse ! Certains candidats pensent à l’œil, mais les
autres n’ont aucune solution…
L’égalité des amplitudes complexes d1 et d2 ne se prouve qu’en comparant les produits
scalaires associés et non pas en affirmant que dS1 = dS.
L’écriture d1 = d2 => 1 = 2 mérite, elle aussi, quelques explications !
L’élément de symétrie caractéristique du phénomène de diffraction provoqué par l’ouverture
(S) n’est pas le centre O, mais l’axe Oz. En revanche, la figure de diffraction observée dans le
plan x’O’y’ admet le point O’ comme centre de symétrie.
A.I.7 Conditions de Gauss
Les conditions se résument à des rayons peu inclinés sur l’axe optique. On oublie que le trajet
de ces rayons doit se situer au voisinage de cet axe.
L’approximation qui en découle permet alors d’écrire tan w
sin w et d’en déduire les
égalités x’ = f’ / et y’ = f’ / .
A.II.1 Amplitude complexe donnée par une ouverture rectangulaire
C’est la partie qui a donné le plus de satisfaction aux correcteurs : elle est souvent bien
abordée et bien traitée. On regrette les erreurs classiques sur les bornes d’intégration 0
l
(au lieu de –l/2
+l/2) et 0
L (au lieu de –L/2
+L/2).
A.II.2-3 Éclairement sur l’écran
Ce paragraphe, plus délicat, est rarement traité jusqu’à son terme. Il semble qu’un blocage au
niveau des mathématiques entrave l’avancée des candidats.
Les figures de diffraction dans le plan x’O’y’ sont souvent correctement décrites et dessinées,
mais le lien avec les questions précédentes n’est pas apparent. Les résultats semblent tombés
du ciel, ou tout simplement, tirés d’expériences vues ou décrites en cours.
A.III Diffraction par une ouverture circulaire
La réponse est souvent intuitive, sans avoir bien vu ce qui se passait auparavant…
B.I.1-2 Formule du réseau
Les candidats étaient bien guidés. Même si certains d’entre eux, encore influencés par les
questions précédentes, ont confondu les angles et leur sinus, la formule du réseau est
généralement bien établie, plus souvent que « parachutée ».
B.I.3 Fabrication d’un réseau
Cette question ne rencontre aucun succès. Très souvent la confusion est faite avec la
construction d’un montage utilisant un réseau plan par transmission (spectroscope, par
exemple).
B.II.1 Comment repérer les directions k ?
Les réponses sont rares. Un schéma de principe, ressemblant « vaguement » à un goniomètre,
est parfois dessiné, mais sans dispositif d’observation. Les séances de travaux pratiques sont
oubliées…
- 11 -

B.II.2 Déviation Dk
Malgré des erreurs de signe, ou de non respect de l’orientation, les étudiants aboutissent
facilement à l’égalité Dk = k – i.
B.II.3-4-5 Minimum de déviation Dm,k
La conclusion est parfois hâtive, après égalisation des différentielles dk et di. La formule du
réseau n’est pas exploitée, et les candidats se raccrochent à leurs souvenirs : les deux égalités
im,k =
k,m et Dm,k = – 2 im,k sont souvent proposées sans démonstration.
B.II.5-6 Formule du réseau au minimum de déviation
Là aussi, quelques candidats sont sauvés par leurs « mémoires »…
C.I.1-2 Tracé de rayons lumineux ; schéma optique du microscope réduit
L’image A1 se retrouve rarement en F2 ! Il semble que les étudiants n’aient jamais étudié le
moindre système simple mettant en jeu des lentilles sphériques minces (microscope, lunette
astronomique, lunette de Galilée, etc.) ! Le tracé de rayons lumineux, à l’image de l’optique
géométrique, est toujours aussi catastrophique. D’ailleurs la différence entre rayon et pinceau
n’est pas acquise.
C.I.3 Grandissement linéaire
Pour la détermination de la formule du grandissement linéaire 1 de l’objectif, l’exploitation
du schéma optique et l’application du théorème de Thalès sont préférées aux réponses
obtenues grâce à de vagues souvenirs ou des formules tirées de la calculette.
C.II.1 Expression de la puissance P
L’expression de la puissance était rappelée, mais cette question n’a pas eu beaucoup de
réponses.
C.II.2 Position de l’œil
Quand un système optique (loupe, microscope, lunette astronomique, lunette de Galilée, etc.)
est réglé pour une vision à l’infini, un œil, supposé normal, n’a pas à accommoder lorsqu’il
observe, à travers l’appareil, l’image finale d’un objet étudié. L’angle ’, sous lequel cette
image définitive est vue, ne dépend pas de la position de l’œil. Il en est de même pour
certaines caractéristiques comme la puissance et le grossissement.
C.II.3-4 Limite de résolution de l’œil
Les applications numériques sont souvent négligées, voire systématiquement oubliées. C’est
regrettable ! Au-delà des points que peut rapporter ce type de réponses, les résultats
numériques permettent de vérifier le bien fondé d’une démarche, d’une démonstration, au
même titre qu’un contrôle d’homogénéité de formule. Un résultat numérique aberrant doit
immédiatement interpeller le candidat !
Les correcteurs en profitent pour rappeler que le nombre de chiffres significatifs doit rester
raisonnable, et qu’un résultat qui en comporte un nombre indécent (parfois 10 !) n’est pas
retenu. Les valeurs numériques proposées dans l’énoncé doivent donner de bonnes
indications à ce sujet !
C.III.1 Tache d’Airy
Des candidats, « perdus en route », n’hésitent pas à aborder courageusement cette dernière
partie, ce qui est possible, en principe pour l’essentiel, mais la pression créée par la fin de la
durée du temps imparti, leur fait perdre leur moyen.
- 12 -
 6
6
1
/
6
100%