Les équations chimiques Comment écrire une équation chimique

1
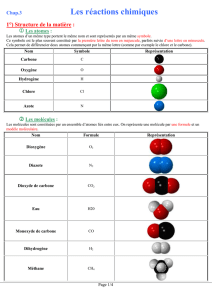
Les équations chimiques
Comment écrire une équation chimique
Une équation chimique est une façon simplifiée pour représenter une réaction chimique.
On l’écrit sous la forme
aA + bB cC + dD
Les lettres minuscules a, b, c, et d sont appelés « les coefficients ».
Les lettres majuscules A, B, C et D représentent les formules des substances chimiques.
Les substances A et B, à gauche de la flèche, sont appelées « les réactifs ».
Les substances C et D, à droite de la flèche, sont appelées « les produits ».
La flèche veut dire « donne ».
Le signe +, avec les réactifs, veut dire « réagit ».
Le signe +, avec les produits, veut dire « et ».
Examinons la transformation suivante :
« L’hydrogène gazeux réagit avec l’oxygène gazeux pour donner de l’eau liquide. »
Cette transformation est chimique!
Son équation nominative avec les noms des réactifs et des produits
hydrogène + oxygène eau
son équation squelette avec les formules des réactifs et des produits
H2 + O2 H2O
Finalement, son équation chimique balancée ou équilibrée??? C’est quoi???
__ H2 + __ O2 __ H2O
On doit balancer une équation chimique pour respecter la loi de conservation de la masse de Lavoisier
et la théorie atomique de Dalton!!!
La loi de conservation de la masse de Lavoisier (Antoine-Laurent Lavoisier, 1743-1794)
« Durant une réaction chimique, rien ne se perd, rien ne se crée, tout se transforme ».
Ou
« Durant une réaction chimique, la masse totale des réactifs est toujours égale à la masse totale des
produits ».

2
En considérant la théorie atomique de Dalton, on peut énoncer la loi de Lavoisier : « Durant une
réaction chimique, les nombres d’atomes de chaque élément, des réactifs et des produits, sont
égaux ».
Comment balancer ou équilibrer l’équation chimique de la réaction entre l’hydrogène et l’oxygène?
__ H2 + __ O2 __ H2O
Examinons les atomes H :
- Dans les réactifs, il y a 2 atomes H. Dans les produits, il y a 2 atomes H. pour le moment, on ne
touche pas au nombre d’atomes H.
Examinons les atomes O :
- Dans les réactifs, il y a 2 atomes O. Dans les produits, il y a 1 atome O. D’après la loi de Lavoisier, il
faut qu’on ait le même nombre d’atomes O dans les réactifs et les produits!!!
Qu’est-ce qu’on doit faire pour respecter cette loi?
Attention : C’est absolument interdit de toucher aux formules qui représentent les molécules des
réactifs et des produits. On peut changer leur nombre mais pas leur structure!
Donc, pour avoir le même nombre d’atomes O, on doit prendre 2 molécules (formules) H2O.
L’équation devient :
__ H2 + __ O2 2H2O
Remarquons maintenant qu’il y a 4 atomes H dans les produits, donc on doit avoir 4 atomes H dans les
réactifs. Quoi faire??? On doit avoir 2 molécules (formules) H2.
2H2 + O2 2H2O
Vérifions si la loi de Lavoisier est respectée :
2H2 + O2 2H2O
Élément
Réactifs
Produits
Égale?
H
4 atomes
4 atomes
oui
O
2 atomes
2 atomes
oui
Note : Les nombres placés devant les formules, pour indiquer le nombre de molécules, sont les
coefficients.
Parlons masse : si 4 g d’hydrogène réagissent avec 32 g d’oxygène, on obtient 36 g d’eau.
Simulation : http://phet.colorado.edu/fr/simulation/balancing-chemical-equations
Retenons
- La masse totale des réactifs = la masse totale des produits. (La masse se conserve)
- Le nombre d’atomes de chaque élément est le même dans les réactifs et les produits.
(Le nombre d’atomes se conserve)
- Le nombre de molécules n’est pas le même dans les réactifs et les produits. (Le
nombre de molécules ne se conserve pas)

3
Les règles pour écrire et balancer des équations chimiques
Balancer des équations chimiques est un processus qui exige de la patience, de l’entrainement et de la
persévérance.
Pour réussir le balancement d’équations chimiques, il est essentiel de savoir nommer et écrire la
formule des composés chimiques.
Les règles suivantes vont vous aider, dans beaucoup des cas, de réussir ce processus.
Ne vous inquiétez pas!
C’est le début!
1. On ne change jamais les formules des réactifs et des produits.
2. On ajuste les coefficients, les nombres qu’on place devant les formules.
3. S’il y a un métal, balance le métal en premier, puis ajoute des coefficients aux autres formules
pour balancer les atomes des éléments qui restent.
4. Balance l’hydrogène, puis l’oxygène à la fin et retourne aux autres éléments pour les balancer, si
nécessaire.
5. Si l’équation contient un ion polyatomique, considère cet ion comme un tout. Ne sépare pas ses
atomes. Commence avec cet ion.
6. Une fois que tu termines, vérifie le nombre d’atomes de chaque élément (la loi de la
conservation de la masse et des atomes).
Rappel important : Ne pas oublier les éléments diatomiques (la molécule est formée de 2 atomes)
qui sont :
- L’hydrogène, de formule H2
- L’oxygène, de formule O2
- L’azote, de formule N2
- Le fluor, de formule F2
- Le chlore, de formule Cl2
- Le brome, de formule Br2
- L’iode, de formule I2
Les métaux sont monoatomiques. Pour un métal, le symbole (qui représente l’atome) et la formule
(qui représente la molécule) sont identiques.
métal
Symbole (atome)
Formule (molécule)
Fer
Fe
Fe
Sodium
Na
Na
Calcium
Ca
Ca
Il est parfois important d’indiquer dans l’équation, l’état des composés chimiques.
État
Abbréviation
État
Abbréviation
solide
(s)
gaz
(g)
liquide
(l)
aqueux (solution dans l’eau)
(aq)

4
Exemple
La réaction chimique : le fer réagit avec le chlore pour donner le chlorure de fer(III).
Équation nominative
fer + chlore chlorure de fer(III)
Équation squelette
Le fer est un solide. Le chlore est un gaz. Le chlorure de fer(III) est solide.
Fe(s) + Cl2(g) FeCl3(s)
Ce qu’il faut faire pour balancer l’équation
- Commencer par le métal Fe : il y a 1 atome Fe dans les réactifs et 1 atome Fe dans le produit.
- Passer au chlore : il y a 2 atomes Cl dans les réactifs et 3 atomes Cl dans le produit. Pour
balancer les atomes de Cl, il y a deux façons :
o On place 3 devant Cl2 et 2 devant FeCl3, pour avoir 6 atomes de chaque côté. L’équation
devient Fe(s) + 3Cl2(g) 2FeCl3(s)
On voit qu’on a 2 atomes Fe dans le produit, donc on met 2 devant Fe dans les réactifs.
L’équation chimique balancée s’écrit :
2Fe(s) + 3 Cl2(g) 2FeCl3(s)
o Ou, on multiplie Cl2 par la fraction 3/2 (2 x 3/2 = 3)
Fe(s) +
3
2
Cl2(g) FeCl3(s)
Mais, on ne peut pas mettre des fractions de molécules ou d’atomes dans l’équation.
Quoi faire? On multiplie tous les composés par 2.
L’équation chimique balancée s’écrit :
2Fe(s) + 3 Cl2(g) 2FeCl3(s)
- On vérifie
Faire visionner ce vidéoclip sur YOUTUBE :
http://www.youtube.com/watch?v=6tucdiflbYA
Élément
Réactifs
Produits
Égale
Fe
2 atomes
2 atomes
oui
Cl
6 atomes
6 atomes
oui
1
/
4
100%