Nom de la solution

Feuille V-1 Chap. 5 : ESPECES CHIMIQUES ET SANTE DOCUMENTS
DOC. 1 : LA SENSATION SUCREE
Le saccharose est un solide dont les solutions aqueuses ont un
goût sucré. On dispose de trois solutions aqueuses de
saccharose préparées comme l’indique le tableau ci-contre.
1) Qu’appelle-t-on une solution ?
2) Quelle espèce chimique joue ici le rôle de soluté ?
3) Quelle espèce chimique joue ici le rôle de solvant ?
4) A votre avis, quelle est de S2 ou S3 la solution la plus
sucrée ? Argumentez brièvement votre hypothèse.
5) A votre avis, quelle est de S1 ou S3 la solution la plus
sucrée ? Argumentez brièvement votre réponse.
6) Calculez la concentration massique de ces trois solutions.
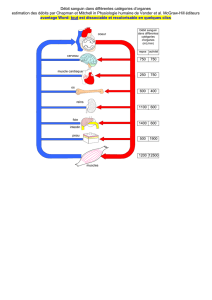
DOC. 2 : ANALYSE DE SANG
Le sang est composé de cellules baignant dans une solution aqueuse : le
plasma sanguin. Les cellules du sang sont les hématies (globules rouges),
les leucocytes (globules blancs) et les plaquettes.
Le plasma sanguin représente 55% du volume sanguin. Il est composé
principalement d’eau dans laquelle sont dissous des molécules et des ions.
Une analyse sanguine permet de déterminer les concentrations de ces
constituants. Elles sont ensuite comparées aux valeurs correspondant à un
état de santé normal, afin de détecter des anomalies susceptibles de mettre
en évidence certaines maladies.
Voici des extraits de résultats d'une analyse de sang :
Valeurs de référence
Valeurs de référence
GLYCEMIE à jeun
1,09 g/L
0,70 à 1,10
SODIUM
143 mmol/L
136 à 145
CHOLESTEROL
2,50 g/L
1,20 à 2,00
POTASSIUM
4,0 mmol/L
3,8 à 4,9
TRIGLYCERIDES
1,82 g/L
0,35 à 1,57
La glycémie à jeun indique la concentration en glucose (de formule C6H12O6) dans le sang après au minimum 12
heures de jeûne. Une valeur inférieure à la référence est le signe d'une hypoglycémie pouvant entraîner un malaise,
voire un coma. Une glycémie à jeun comprise entre 1,10 et 1,25 g/L traduit un état dit d'intolérance au glucose, qui
peut être le signe précurseur d'une maladie, le diabète. Une valeur supérieure ou égale à 1,26 g/L obtenue lors de
deux analyses successives indique un diabète effectif.
Des concentrations trop élevées en cholestérol (C27H46O) et en triglycérides sont des facteurs majeurs de risque de
maladies cardio-vasculaires.
L’ion sodium Na+ joue un rôle essentiel dans le passage de l’eau à travers les parois cellulaires. Sa concentration
dans le sang est appelée natrémie. Une hypernatrémie peut résulter d’une déshydratation. Le rôle des ions potassium
K+ est capital, et leur concentration dans le sang, appelée kaliémie se doit de rester dans une fourchette très précise :
l'hypokaliémie mais surtout l'hyperkaliémie peuvent provoquer un arrêt cardiaque.
QUESTIONS :
1. Qu’appelle-t-on le plasma sanguin ? Quels sont les types de solutés qui y sont dissous ? Donnez des exemples
de chaque type.
2. Qu’appelle-t-on glycémie à jeun ?
3. En observant, les extraits de l’analyse sanguine, que remarquez-vous quant aux unités possibles pour la
concentration en soluté ?
4. Quelle est l’utilité des valeurs de référence ?
5. Quelle pourrait être la conclusion de cette analyse sanguine ?
6. Le volume sanguin dans le corps humain a une valeur moyenne de 6,0 L. le plasma sanguin représente 55% du
volume sanguin. Déterminer le volume du plasma sanguin dans le corps humain.
7. En déduire la valeur de la masse totale de glucose contenue dans plasma du patient.
DOC. 3 : QUANTITE DE MATIERE
Dans la partie précédente, on a étudié la concentration massique et on s’est donc intéressé à la masse des solutés
dissous dans les solutions. Dans cette nouvelle partie, on s’intéresse à la quantité des solutés. Il nous faut donc
trouver un moyen de compter ces molécules ou de ces ions dissous dans les solutions.
I- Inspirons-nous de la vie courante…
a. Dans la vie de tous les jours, il ya des objets qu’on ne trouve pas à l’unité mais par « paquets ». Citez-en
quelques-uns.
b. Donnez deux raisons expliquant pourquoi on ne trouve pas ces objets à l’unité.
c. Comment fait-on en pratique pour prélever une quantité connue de tels objets, pour les besoins d’une recette
de cuisine par exemple ?
d. Comment fait-on en pratique pour prélever une quantité connue de tels objets, pour les besoins d’une recette
de cuisine par exemple ?
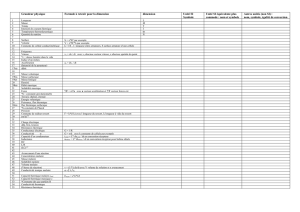
Nom de la
solution
Masse de
saccharose
dissous
Volume de la
solution
S1
m1 = 0,8 g
V1 = 50 mL
S2
m2 = 3,4 g
V2 = 100 mL
S3
m3 = 0,8 g
V3 = 100 mL
Analyse de sang. Les résultats sont comparés à des
normes qui diffèrent selon l'âge et le sexe du patient.

II- Pour raisonner sur la chimie.
Des travaux menés au XIXe siècle et portés à leur stade ultime par le physicien Jean Perrin au
début du siècle suivant ont permis d'établir qu'il y a 6,02x1023 atomes dans 12,0 g de l'isotope
12C du carbone. Ce nombre très grand, noté NA, est appelé la constante d'Avogadro.
Il montre qu'il serait difficile de déterminer directement le nombre d'entités contenues dans
des échantillons de matière observables à l'échelle humaine, c'est-à-dire à l'échelle
macroscopique. Les scientifiques ont donc décidé de décrire ces échantillons au moyen d'une
grandeur physique : la quantité de matière, notée n. Cette grandeur possède une unité : la
mole, de symbole mol.
Par convention, 1 mole d'entités (atomes, ions ou molécules) équivaut à 6,02x1023 entités.
a. A l’échelle macroscopique, les chimistes comptent-ils les atomes, les ions et les
molécules à l’unité ou par paquet ? Pour quelles raisons ?
b. Comment se nomme « un paquet » en chimie ? Combien d’entités contient-il ?
c. Donner une définition de la quantité de matière en chimie.
d. Quelle est la masse d’une mole de carbone ?
Le charbon végétal est utilisé dans le traitement des troubles du transit
intestinal. Il se présente sous la forme d'une poudre noire, essentiellement
constituée d'atomes de carbone. Une capsule vendue dans le commerce
contient 300 mg de charbon végétal.
e. Calculer la quantité d’atomes de carbone contenus dans une capsule.
EXERCICE 1 : DOSE JOURNALIERE ADMISSIBLE DE LA SACCHARINE.
Certains produits de consommation courante sont soumis à des
normes. C'est le cas des additifs alimentaires et des édulcorants.
La norme s'appelle la « dose journalière admissible » (DJA) et
correspond à la masse maximale consommable par kg de masse
corporelle. Les valeurs sont établies par un comité d'experts de
l'Organisation pour l'alimentation et l'agriculture (PAO) et par
l'Organisation mondiale de la santé (OMS). Le tableau ci-contre propose un exemple de DJA pour les édulcorants.
1. Qu’est-ce qu’un édulcorant ?
2. Quelle masse de saccharine peut consommer par jour une personne de 60 kg. Exprimer le résultat en gramme.
3. Un sirop contre la toux a une concentration de 25 g/L en saccharine.
a. Quel est le volume maximal de sirop que peut absorber par jour une personne de 60 kg ?
b. Sachant que le volume d’une cuillère à café est estimé à environ 5 mL, combien de cuillères à café sont
tolérées par jour ?
Pour tous les exercices, on donne les
masses molaires atomiques dans le
tableau suivant :
EXERCICE 2 : La masse molaire de la vitamine C est égale à 176 g.mol-1. Retrouvez sa formule brute parmi les
formules suivantes :
a. C3H6O b. C6H8O6 c. C12H22O11
EXERCICE 3 : ANALYSE DE SANG
D'après les résultats de son analyse sanguine, un patient constate que son taux de cholestérol est égal à
7,90 mmol par litre de sang. La formule brute du cholestérol est C27H460.
1. Calculer la masse molaire moléculaire du cholestérol.
2. À quelle masse correspondent 7,90 mmol de cholestérol ?
3. Le taux de cholestérol reste acceptable jusqu'à 2,20 g par litre de sang. Ce patient doit-il s'inquiéter ?
EXERCICE 4 : Les solutions pour perfusion « chlorure de sodium 0,9 % » sont des solutions aqueuses qui
contiennent 9,0 mg de chlorure de sodium pour 1,0 mL de solution.
1. Calculer la concentration massique en chlorure de sodium d'une telle solution.
2. Calculer la masse molaire du chlorure de sodium.
3. En déduire la concentration molaire de la solution en chlorure de sodium.
EXERCICE 5 : SOLUTION DE SUCRE
On veut préparer un sirop très léger de fructose (C6H1206), qui est un sucre. Pour cela, on pèse 250 g de ce sucre, que
l'on dissout dans 2,0 L d'eau.
1. Calculer la masse molaire moléculaire du fructose.
2. Donner le protocole pour réaliser cette dissolution.
3. Quelle est la concentration molaire de ce sirop en fructose ?
Edulcorant
DJA (mg/kg)
Acésulfame de potassium
15
Aspartame
40
Cyclamate
7
Saccharine
5
Elément
H
C
N
0
Na
Cl
Masse molaire en g.mol-1
1,0
12,0
14,0
16,0
23,0
35,5
Le physicien français
Jean Perrin (1870-1942) a
déterminé par treize tech-
niques différentes la
valeur de la constante
d'Avogadro.

Feuille V-1 Chap. 5 : ESPECES CHIMIQUES ET SANTE DOCUMENTS
EXERCICE 5 : FATIGUE PASSAGERE
Un médicament antiasthénique peut être utilisé dans le traitement d'appoint de la fatigue, lorsque celle-ci n'est pas due à une maladie. Sa
notice indique la composition suivante : les masses sont données pour un comprimé de 4,3 g, à dissoudre dans un verre d'eau.
Glucuronamide 400 mg Acide
ascorbique (vitamine C) 500 mg Caféine
50 mg Sodium 616 mg
Saccharose 158mg
Formules brutes des composés moléculaires : glucuronamide : C6H1:1N06, acide ascorbique : C6Hg06, caféine : C8H10N402, saccharose : C12H22Oir
1. Chaque comprimé contient-il d'autres espèces que celles indiquées dans sa composition ? Justifier.
2. Le comprimé est totalement dissous dans un verre d'eau : le volume de solution (homogène) est alors égal à 20 cL. Sous quelle forme le
sodium se trouve-t-il dans la solution ?
3. Calculer la concentration massique de chaque espèce dans la solution obtenue.
1
/
3
100%