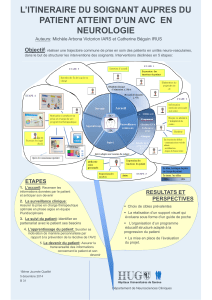
Télécharger

Stimulation magnétique transcrânienne répétitive dans
l’AVC ischémique : où en est-on ?
Publié le 02/05/2013 jim
N. KUBIS,
Service de Physiologie clinique-Explorations fonctionnelles, hôpital Lariboisière, Paris
Illustration/figure 2. : Application de la bobine sur le scalp au-dessus du cortex moteur primaire (M1) et genèse
d’un courant électrique dépôlarisant les neurones sous la bobine.
Après un accident vasculaire cérébral (AVC), les patients peuvent s’améliorer spontanément dans les 3
premiers mois, puis de manière plus lente dans l’année qui suit. Les premiers jours, la diminution de
l’oedème et la reperfusion de la pénombre ischémique peuvent éventuellement rendrecompte de ces
phénomènes, mais l’amélioration du déficit neurologique dans les semaines qui suivent suggère des
phénomènes de plasticité et de réorganisation corticale du cerveau, non seulement des aires lésées,
mais aussi des aires plus à distance(1). Stimuler cette plasticité cérébrale est devenu un enjeu de
recherche majeur car la fenêtre thérapeutique est alors élargie bien au-delà des 4-5 pre - mières heures
autorisées à la fibrinolyse.
La stimulation magnétique transcrânienne répétitive (SMTr) est l’un des outils de stimulation de la plasticité
cérébrale. La récupération de l’aphasie et de l’héminégligence après SMTr ne sera pas abordée dans cette
revue, la récupération du déficit moteur ayant été de loin la plus étudiée.
La stimulation magnétique transcrânienne répétitive : principes et méthodes
La stimulation magnétique transcrânienne (SMT) a été mise au point il y a une vingtaine d’années et est
actuellement la méthode de choix d’activation du cortex cérébral chez l’homme (2). Elle est appliquée via une
bobine à l’intérieur de laquelle circule un courant électrique de haute intensité, déchargé en quelques μs, qui
génère un champ magnétique de 2 à 2,5 teslas d’une durée de 0,3 à 1 ms. Lorsque la bobine est placée au-
dessus du scalp, le courant magnétique peut franchir la boîte crânienne jusqu’au cortex, sans atténuation et sans
douleur. Il induit un courant électrique (principe de Faraday) au niveau du cortex qui s’annule au-delà de 3 cm,
mais qui permet la dépolarisation des neurones du cortex situés immédiatement sous le champ magnétique.
L’apparition des bobines en « 8 », a permis d’obtenir une stimulation plus focale à une intensité plus basse
qu’avec les bobines circulaires (figure 1).
Figure 1. Présentation du matériel de stimulation magnétique transcrânienne.
Enfin, les machines de SMT sont capables de produire des chocs « uniques », « doubles » (avec un intervalle
inter-stimuli très bref), mais aussi des « trains » de stimulation émis à basse fréquence (< 1 Hz) ou à haute
fréquence (≥ 1 Hz jusqu’à 100 Hz). La SMT étudie classiquement l’excitabilité de la voie corticospinale, c’est-à-
dire les carac - téristiques de la propagation du potentiel d’action généré dans les neurones issus du cortex
moteur, jusqu’au muscle cible (figure 3).

Figure 3. Méthode d’obtention du potentiel évoqué moteur (PEM).
Ces « potentiels évo qués moteurs » (PEM) sont détectés à l’aide d’élect rodes d’enregist rement de surface, puis
leur latence et leur amplitude sont analysées. Le seuil moteur correspond au niveau d’excitabilité minimal du
cortex moteur. Il est défini par l’intensité de stimulation à partir de laquelle il est possible de produire des
réponses ≥ 50 μV dans un muscle au repos ou ≥ 100 μV dans un muscle activé pour au moins 3/6 stimulations.
Le seuil moteur est un des critères de la mesure de l’excitabilité corticale d’une région. Le choix du site de
stimulation sur le cortex repose sur l’homonculus ou la cartographie du cortex moteur décrite par Penfield et
Rasmussen (1950). Depuis une douzaine d’années, la SMT répétitive (SMTr), outil non invasif et indolore, a été
développée à des fins thérapeutiques. La SMTr à basse fréquence (< 1 Hz) inhibe le cortex, alors que la SMTr à
haute fréquence (≥ 1 Hz) l’excite. Le traitement de la dépression sévère par la SMTr, en alternative à la
sismothérapie, a été approuvé aux États-Unis par la Food Drug Administration en 2008. Dans la prise en charge
de la douleur résistante au traitement pharmacologique, l’application de séries de trains de 10 Hz sur le cortex
moteur permet de sélectionner en pré-opératoire les patients qui seront répondeurs à l’implantation d’électrodes
intracérébrales, et permet d’atténuer transitoirement les douleurs (3). Si les paramètres de stimulation « op
timaux » restent encore à déterminer en fonction des indications thérapeutiques, les études réalisées depuis une
dou zaine d’années ont montré l’innocuité de cet outil chez l’homme, que cela soit à haute ou à basse fréquence,
de manière répétée, à court et à moyen terme. Dans la pathologie vasculaire cérébrale, les études sont beaucoup
moins nombreuses et ont été initialement développées à partir de l’observation des modifications de l’excitabilité
corticale survenant dès les premiers jours après un AVC.
La SMTr à basse fréquence (< 1 Hz) inhibe le cortex,
alors que la SMTr à haute fréquence (≥ 1 Hz) l’excite.
AVC et excitabilité corticale

Le cortex ipsilatéral à l’AVC, mais aussi de l’hémisphère controlatéral, subit une modification de son excitabilité
au cours du temps. Il existe chez le sujet sain un équilibre entre les projections inhibitrices réciproques des
régions homonymes corticales motrices de chacun des hémisphères. Cette inhibition réciproque a été mise en
évidence par la mesure de l’amplitude du PEM (potentiel évoqué moteur) chez le volontaire sain après stimulation
à basse fréquence d’une aire motrice primaire (M1) pendant 30 minutes (4) : la stimulation à basse fréquence
diminue l’excitabilité du cortex moteur stimulé, empêchant ainsi (« inhibant ») l’inhibition transcalleuse du cortex
moteur primaire controlatéral : on mesure alors une augmentation de l’excitabilité de la région M1 controlatérale,
qui est moins inhibée (figure 4). Cet équilibre est perturbé lors
d’un AVC. N. Murase et coll.
(5) ont montré chez des
patients ayant un infarctus
sous-cortical une
augmentation précoce, 10
jours après l’AVC, de
l’inhibition interhémisphérique
du M1 de l’hémisphère sain
vers le M1 de l’hémisphère
lésé et à l’inverse, une
diminution de l’inhibition
interhémisphérique du M1 de
l’hémisphère lésé vers le M1
de l’hémisphère sain. Cette
activité de la zone homonyme
controlatérale est d’autant plus
importante que le patient est
déficitaire, comme cela a été
montré par l’imagerie
cérébrale fonctionnelle (6) et
par la mesure de l’excitabilité
corticale. Ces travaux ont
permis ainsi de définir des
critères pronostiques :
l’existence de potentiels
évoqués moteurs (PEM) à la
phase aiguë de l’AVC est un
facteur prédictif de meilleure
récupération ; à l’inverse, l’absence de réponse à la stimulation précoce est associée à un mau vais pronostic
fonctionnel (7), comme l’importance de la réponse du côté sain.
L’existence de potentiels évoqués moteurs (PEM) à la phase aiguë de l’AVC
est un facteur prédictif de meilleure récupération.
Ce déséquilibre de l’inhibition interhémisphérique transcalleuse est utilisé dans les techniques de rééducation
dites de « constraint induced therapy », ou de contrainte induite, au cours desquelles le membre sain est
immobilisé pendant 1 à 2 semaines, afin de désactiver la région corticale motrice primaire lui correspondant et de
diminuer l’inhibition transcalleuse. Ainsi, pour de favoriser la récupération motrice après un AVC, il faut soit
directement exciter la région corticale motrice ipsilatérale à l’AVC, qui est hypoactivée, soit indirectement inhiber
la région motrice primaire controlatérale qui est suractivée et exerce une inhibition réciproque sur sa région
homonyme, préjudiciable à la récupération (figure 4). Cette modulation de l’excitabilité cérébrale est possible
grâce à la SMTr en appliquant une stimulation à haute fréquence sur l’hémisphère lésé pour favoriser son
activation, ou une stimulation à basse fréquence sur l’hémisphère controlatéral « sain » pour susciter son
inhibition.
Les essais cliniques au cours de l’AVC par la SMTr
Les premières études de récupération motrice après un accident vasculaire cérébral chez des patients soumis à
un protocole de sessions uniques ou répétées de SMTr ont été essentiellement réalisées chez des patients au
stade chronique, entre 3 et 12mois après l’AVC, voire plus de 12 mois (8). Chez ces patients chroniques, la
région motrice primaire controlatérale à l’AVC a été inhibée dans 3 études (9-11), tandis que les régions du cortex
primaire respectivement controet ipsi-latérale à l’AVC ont été excitées dans les deux autres (8,12). Ces patients
présentaient des infarctus sous-corticaux pour la plupart et étaient par conséquent relativement homogènes sur le
plan clinique et radiologique. Ils ont été randomisés pour recevoir en cross over, à une semaine d’intervalle, la
stimulation réelle ou la stimulation « sham », c’est-à-dire non susceptible d’induire un courant électrique (9,12), ou
bien ils ont été tirés au sort pour recevoir l’une ou l’autre et comparés (8,10,11). La stimulation « sham » a été
réali - sée par une bobine inactive ou une bobine active, dont l’orientation est modifiée en regard du scalp de
Figure 4. Principes de l’inhibition interhémisphérique
ou transcalleuse réciproque et déséquilibre lors de la
survenue d’un accident vasculaire cérébral (représenté
en bleu).

manière à ne pas pouvoir activer les fibres corticales. L’évaluation a été réalisée à l’aide de mesures d’habileté
manuelle pour toutes (mesure informatisée de la précision et de la rapidité de la réalisation d’un mouvement
standardisé), ainsi qu’une échelle de spasticité (Ashworth Spasticity Score), notamment dans celle de F. Fregni et
coll. (11). L’amélioration de ces échelles a été constatée avec une pérennité de l’effet obtenu dès lors que la
stimulat ion étai t répétée plusieurs jours (11), comme cela avait d’ailleurs été mis en évidence lors des études de
SMTr au cours de la dépression et de la douleur. Seule l’étude de M.P. Macolm et coll. (8) n’a montré qu’une
tendance à l’amélioration sans que celle-ci soit significative.
Malheureusement, aucune de ces études n’a une procédure com - mune et l’ensemble des paramètres
d’excitabilité corticale n’a pas été con trôlé de manière concomitante, rendant difficile l’interprétation de ces
résultats di - ver gents. Les études réalisées à la phase aiguë sont plus rares. A.B. Conforto et coll. (13) ont validé
l’hypothèse selon laquelle il existe une inhibition transcalleuse néfaste de l’hémisphère sain sur l’hémisphère
lésé, 5 à 45 jours après l’AVC, en montrant une amélioration significative des paramètres moteurs après
stimulation à basse fréquen ce de l’hémisphère controlatéral à l’AVC.
En 2010, pour la première fois une pérennité à 1 an de l’effet de la SMTr
à haute fréquence a été observée chez 48 patients traités à la phase aiguë.
E.M. Khedr et coll. (14) ont excité la région motrice M1 ipsilatérale à l’AVC chez des patients qui avaient eu un
AVC dans les 10 jours.
Ils ont utilisé des échelles de
handicap moteur et de score
neurologique (Barthel,
Scandinavian Stroke Scale et
NIHS) permettant de prendre
en compte un déficit plus
étendu que seul celui de la
main testé pour les autres
études. En 2010, cette même
équipe a montré pour la
première fois une pérennité à
1 an de l’effet de la SMTr à
haute fré - quence chez 48
patients traités à la phase
aiguë (15). Deux types de
stimulation excitatrice ont été
comparés (3 et 10 Hz), mais
aucune différence significative
n’a été mise en évidence entre
les deux. N. Sasaki et coll.
(16) ont comparé à la phase
aiguë, chez des patients inclus
entre 6 et 29 jours après
l’AVC, la SMTr de haute
fréquence, la SMTr de basse
fréquence et un groupe «
sham » : la stimulation de
haute fréquence était la plus
efficace, à ce stade, dans cet
te populat ion, qui comportait
pour moitié des AVC
hémorragiques. Plus récemment, A. Avenanti et coll. (17) ont évalué l’intérêt de la chronologie de la session de
SMTr par rapport à la séance de rééducation classique : les patients ayant un AVC chronique avec un déficit
moteur modéré du membre supérieur étaient soumis à la SMTr de basse fréquence sur l’hémisphère sain
pendant 2 semaines, immédiatement avant ou immédiatement après la séance de rééducation, et étaient
comparés à un groupe placebo (bobine non active) soumis à la même procédure. Les performances motrices à
quand 1 et 3 mois ont été meilleures, la SMTr avait précédé la séance de rééducation suggérant un effet «
d’amorçage » de la plasticité cérébrale par la technique de SMTr.
Précaution d’emploi et de sécurité
La SMTr expose en théorie à un risque accru d’épilepsie, ce d’autant qu’el le est appl iquée à haute fréquence, à
la phase aiguë et sur un cortex hémorragique. Cependant, à ce jour, aucune crise d’épilepsie n’a été rappor tée
chez les pat ients soumis à cette procédure, en particulier dans les études d’excitation corticale à la phase aiguë
des AVC. F. Fregni et coll.(11) avaient de plus réalisé un enregistrement systématique de l’EEG, qui ne s’est pas
modifié ; il s’agissait cependant d’AVC chroniques et l’inhibition corticale controlatérale à l’AVC était recherchée.

Références
1. Chen R et al. Nervous system reorganization following injury. Neuro - science 2002 ; 111 : 761-73.
2. Barker AT et al. Non-invasive magnetic stimulation of the human motor cortex. Lancet 1985 ; 1(8437) : 1106-7.
3. Lefaucheur JP et al. Interventional neurophysiology for pain control: duration of pain relief following repetitive
transcranial magnetic cortical stimulation of the motor cortex. Neurophysiol Clin 2001 ; 31(4) : 247-52.
4. Schambra YH et al. Modulation of excitability of human motor cortex (M1) by 1 Hz transcranial magnetic
stimulation of the contralateral M1. Clin Neurophysiol 2003 ; 114(1) : 130-3.
5. Murase N et al. Influence on interhemispheric interactions on motor function in chronic stroke. Ann Neurol 2004
; 55(3) : 400-9.
6. Ward NS, Frackowiak RSJ. The functional anatomy of cerebral reorganisation after focal brain injury. J Physiol
2006 ; 99(4-6) : 425-36.
7. Delvaux V et al. Post-stroke reorganization of hand motor area: a 1-year prospective follow-up with focal
transcranial magnetic stimulation. Clin Neurophysiol 2003 ; 114(7) : 1217-25.
8. Macolm MP et al. Repetitive transcranial magnetic stimulation as an adjunct to constraint-induced therapy: an
exploratory randomized controlled trial. Am J Phys Med Rehab 2007 ; 86 : 707-15.
9. Mansur CG et al. A sham stimulation- controlled trial of rTMS of the unaffected hemisphere in stroke patients.
Neurology 2005 ; 64(10) : 1802-4.
10. Takeuchi N et al. Repetitive transcranial magnetic stimulation of contralesional primary motor cortex improves
hand function after stroke. Stroke 2005 ; 36(12) : 2681-6.
11. Fregni F et al. A sham-controlled trial of a 5-day course of repetitive transcranial magnetic stimulation of the
unaffected hemisphere in stroke patients. Stroke 2006 ; 37(8) : 2115-22.
12. Kim YH et al. Repetitive transcranial magnetic stimulation-induced corticomototor excitability and associated
motor skill acquisition in chronic stroke. Stroke 2006 ; 37(6) : 1471-6.
13. Conforto AB et al. Transcranial magnetic stimulation in mild to severe hemiparesis early after stroke: a proof
of principle and novel approach to improve motor function. J Neurol 2012 ; 259(7) : 1399-405.
14. Khedr EM et al. Therapeutic trial of repetitive transcranial magnetic stiumlation after acute ischemic stroke.
Neurology 2005 ; 65(3) : 466-8.
15. Khedr EM et al. Long-term effect of repetitive transcranial magnetic stimulation on motor function recovery
after acute ischemic stroke. Acta Neurol Scand 2010 ; 121(1) : 30-7.
16. Sasaki N et al. Comparison of the effects of high- and low-frequency repetitive transcranial magnetic
stimulation on upper limb hemiparesis in the early phase of stroke. J Stroke Cerebrovasc Dis 2011 Dec.14 (Epub
ahead of print).
17. Avenanti A et al. Low-frequency rTMS promotes use-dependent motor plasticity in chronic stroke: a
randomized trial. Neurology 2012 ; 78 : 256-64.
Copyright © Len medical, Neurologie pratique, mars 2013
1
/
5
100%