Chapitre 7:

CH. 7: Hybridation des orbitales-Règle de Gillespie O. Selaïmia Ferdjani
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
1
Chapitre 7: Hybridation des orbitales-
Règle de Gillespie
I- hybridations des orbitales
Tout comme les OA d’atomes différents peuvent se mélanger pour former des OM, de la même
manière les OA d’un même atome peuvent se combiner pour donner naissance à des orbitales
hybrides.
La théorie d’hybridation :
permet d’expliquer la géométrie de certaines molécules.
Donne aussi les valeurs des angles que font entre elles les directions des liaisons dans une
molécule polyatomique.
Il existe trois types d’hybridation : sp3, sp2 et sp.
I-1 Hybridation sp3 : tétragonale
Exemple CH4
Les orbitales atomiques intervenants dans la formation de la molécule CH4 sont les orbitales 2s et 2p
de l'atome de Carbone qui vont se recouvrir avec les orbitales 1 s de l'Hydrogène.
Les orbitales s étant sphériques et les orbitales p pointant selon les trois axes cartésiens on ne peut
simplement expliquer l'obtention d'une molécule tétraédrique.
On devrait donc avoir :
3 liaisons à angle droit et 1 liaison non directionnelle :
Ce modèle simple ne rend donc pas compte de la géométrie tétraédrique réelle.
Dans la molécule CH4, Les quatre liaisons C-H sont identiques. Elles font un angle de 109°28’.
Une structure tétraédrique régulière a été adoptée avec le carbone au centre de polyèdre et les
atomes d’hydrogène aux sommets.
Pour expliquer cette forme tétraédrique de CH4 on procède par étape.
1ère étape
6C : 1s2 2s2 2p2 à l’état fondamental.
On ne considère que les électrons de valence. Le carbone possède 2 électrons célibataires.
Il ne peut former que deux liaisons.
2ème étape
C* : 1s2 2 s1 2 p3 à l’état excité.
Selon l’état excité :
Le carbone présente quatre électrons célibataires. On peut donc expliquer quatre liaisons dont
seulement trois sont identiques, ce qui est en désaccord avec l’expérience.
3ème étape
Orbitales hybrides sp3
On considère que le carbone dans son état réactionnel possède quatre orbitales hybrides équivalentes
qui sont obtenues en mélangeant les orbitales atomiques de base 2s, 2px, 2py et
2pz → 1s + 3p = 4sp3
Etat fondamental Etat excité Etat d’hybridation sp3

CH. 7: Hybridation des orbitales-Règle de Gillespie O. Selaïmia Ferdjani
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
2
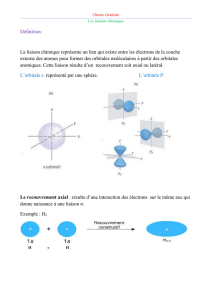
L’hybridation sp3 ne permet que des liaisons .
L’hybridation sp3 permet une géométrie tétraédrique de la molécule de CH4.
La liaison σ est un recouvrement axial entre les atomes formant la liaison. Les électrons se situent
entre les deux noyaux.
I-2 Hybridation sp2 : trigonale
Exemple1 : L'éthylène C2H4
Cette molécule est plane avec des H-C-H et H-C-C de 120°.
Pour décrire cette molécule l'hybridation de type sp3 ne convient pas, nous allons faire appel à une
hybridation de type sp2.
L'exposant 2 indique ici que seules deux orbitales p seront combinées avec l'orbitale s pour obtenir ce
type d'orbitales hybrides.
Il restera donc une orbitale p sur chaque atome de carbone : 1 s + 3 p = 3 sp2 + 1 p
Ces orbitales hybrides sp2 pointeront dans les directions d’un triangle équilatéral centré sur 1 atome de
Carbone.
Etat fondamental Etat d’hybridation sp2 3 liaisons et 1 liaison

CH. 7: Hybridation des orbitales-Règle de Gillespie O. Selaïmia Ferdjani
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
3
Orbitales sp2 dans un même plan :
Orbitale p parallèles Liaison possible
La libre rotation autour de l'axe de la liaison n'est pas possible sans rupture de cette liaison et donc
destruction de la molécule.
Les six orbitales sp2 étant dans le même plan,
toutes les liaisons sont coplanaires et la molécule
est obligatoirement plane.
Exemple2 : CH2NH
Exemple3 : CH2O
I-3 Hybridation sp : digonale ou linéaire
Exemple1 : l’acétylène C2H2
La molécule est linéaire. Les deux liaisons C-H sont identiques et font un angle de 180° entre elles.
Les orbitales hybrides sp sont obtenues par combinaison linéaire d’une orbitale s avec une orbitale p :
1s + 3p = 2sp + 2p
Ici deux recouvrements latéraux conduiront à la formation de deux liaisons .
Molécule d'Acétylène
L’état d’hybridation sp donne une structure
linéaire.
Exemple2 : BeH2
4Be : 1s2 2s2

CH. 7: Hybridation des orbitales-Règle de Gillespie O. Selaïmia Ferdjani
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
4
Etat fondamental Etat excité 1s + 3p = 2sp + 2p
Exemple3 : CHN
I-4 Hybridation des orbitales d
Cas des complexes
Fe, Co Ni, P, S, … font intervenir leurs orbitales d pour faire sp3d, sp3d2, sp3d3,…Ce genre
d’hybridation, faisant intervenir d, se retrouve généralement dans les complexes.
Rappel : Un complexe est un ensemble formé d’un atome central, lié à un certain nombre de
groupements (ions, molécules) appelés Ligands
a- Hybridation sp3d
Exemple PCl5 (5 liaisons autour de P : Octet non respecté - composé hypervalent)
15P : 1s2 2s2 2p6 3s2 3p3 3d0 à l’état fondamentale
Pour faire 5 liaisons P doit s’hybrider sp3d (autrement dit combinaison d’une orbitale s, 3 orbitales p et
une orbitale d) soit 5 orbitales hybrides de la manière suivante :
On aura alors comme structure électronique de l' atome de phosphore la structure suivante:
[Ne] 3s1 3p3 3d1 à l’état excité 1 s+ 3 p+ 1 d = 5 orbitales atomiques hybrides "dsp3".
Cl : …/3s2 3p5
Chaque orbitale atomique hybride sp3d contient un électron célibataire qui vient s' unir, par fusion
axiale, avec une orbitale 3p de chaque atome de chlore contenant un électron célibataire.
Représentation bipyramide à base triangulaire
b- Hybridation sp3d2

CH. 7: Hybridation des orbitales-Règle de Gillespie O. Selaïmia Ferdjani
--------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
5
Exemple 1 [Fe(NH3)6]2+ = Fe2+ + 6 NH3 Obtenu de la manière suivante :
26Fe : …/ 4s2 3d6 4 p0
Fe2+ : …/3d6 4s0 4p0
A l’état excité, Fe2+ :
3d6 4s0 4p0
1s + 3p + 2d = 6 orbitales hybrides d2sp3
7N : …/2s2 2p3
Dans NH3, il reste un doublet libre pour établir une liaison dative.
Les 6 OA hybrides sp3d2 de Fe sont vides, donc capable d’accepter les doublets des NH3.
Bipyramide à base carrée : octaèdre (8 faces).
Exemple 2 : PCl6-
P- : 1s2 2s2 2p6 3s2 3p4 3d0 → P-: …/3s1 3p3 3d2
Chaque orbitale atomique hybride d2sp3 contient un électron célibataire qui vient s' unir, par fusion
axiale, avec une orbitale 3p de chaque atome de chlore contenant un électron célibataire.
b- Hybridation sp3 d3
Exemple IF7: bipyramide pentagonale
53I :…/ 4d10 5s2 5p5 à l’état fondamental
I* :…./ 4d10 5s1 5p3 5d3
1s +3p + 3d = 7 orbitales hybrides sp3d3
Chaque orbitale atomique hybride sp3d3 contient un électron célibataire qui vient s' unir, par fusion
axiale, avec une orbitale 3p de chaque atome de fluor contenant un électron célibataire.
Géométrie : bipyramide pentagonale.
Remarque: - [Co(CN)6]3- est diamagnétique
- [CoF6]3- est paramagnétique
- [Fe(CN)6]4- = Fe2+ + 6 CN- est paramagnétique
- [Fe(NH3)6]2+ : diamagnétique
Hybridation sp2d
Exemple PtCl42- = Pt2+ + 4Cl-
L’ion centrale Pt2+ contient 8 e- d
Pt2+ : 54[Xe] 4f14 5d8 6s0
A l’état excité on a :
5d8 4s0 3p0
Cl-1d + 1s + 2p = 4 orbitales hybrides sp2d Cl- Cl-
Cl-:…/3s2 3p6
Forme géométrique carrée Pt2+
Cl- Cl-
II- Règle de GILLESPIE ou Méthode V.S.E.P.R. (Valence Schell Electronic Pair Repulsion)
Appelée également Méthode R.P.E.C.V (Répulsion des Paires Electroniques de la Couche de
Valence)
Ce n’est pas une nouvelle théorie de la liaison, mais un procédé de raisonnement (simple et efficace)
qui permet de prévoir de façon qualitative la géométrie des petites molécules covalentes. Ce modèle
est basé sur la répulsion des paires électroniques de la couche de valence.
II-1 Principe de la méthode
Dans une molécule, l’atome central est entouré par des doublets d’électrons :
Doublets de liaisons : X
Doublets libres : E
Ces doublets électriquement chargés se repoussent Ils vont se placer le plus loin possible les uns des
autres sur une sphère centrée sur l’atome central A.
 6
6
 7
7
 8
8
1
/
8
100%