pile et électrolyse.

Guibal Bellevue TS ch : 3. Sens spontané d’évolution est-il prévisible? (pile et électrolyse) 1/6
Partie C : Le sens « SPONTANE » d’évolution d’un
système est-il PREVISIBLE ?
Le sens d’évolution d’un système chimique peut-il être INVERSE?
Les savoir-faire
1- Un système chimique évolue spontanément vers l'état d'équilibre (carte mentale)
En disposant de l'équation d'une réaction, donner l'expression littérale du quotient de réaction
Qr , et calculer sa valeur dans un état donné du système.
Savoir qu'un système évolue spontanément vers un état d'équilibre.
Etre capable de déterminer le sens d'évolution d'un système donné en comparant la valeur du
quotient de réaction dans l'état initial à la constante d'équilibre, dans le cas de réactions acido-
basiques et d'oxydoréduction.
2- . Les piles, dispositifs mettant en jeu des transformations spontanées permettant de récupérer
de l'énergie (carte mentale)
Schématiser une pile. Utiliser le critère d'évolution spontanée déterminer le sens de
déplacement des porteurs de charges dans une pile.
Interpréter le fonctionnement d'une pile en disposant d'une information parmi les suivantes: sens
de circulation du courant électrique, f.é.m. , réactions aux électrodes, polarité des électrodes ou
mouvement des porteurs de charges. Animation Flash Pile
Ecrire les réactions aux électrodes et relier les quantités de matière des espèces formées ou
consommées à l'intensité du courant et à la durée de la transformation, dans une pile et lors d'une
électrolyse.
3- 3 - Exemples de transformations forcées (version imprimable)
Savoir qu'une électrolyse est une transformation forcée.
Connaissant le sens du courant imposé par le générateur, identifier l'électrode à laquelle se
produit la réaction d'oxydation (anode) et l'électrode à laquelle se produit la réaction de réduction
(cathode). Animation Flash électrolyse
1- Comment PREVOIR le SENS d’évolution d’un système chimique ?
1- 1 Rappel sur le quotient de réaction
Définition de Qr
On associe à une réaction du type : a A(aq) + b B(aq) = c C(aq) + d D(aq)
avec a, b, c, d les nombres stœchiométriques et A, B : les réactifs et C et D : les
produits, le quotient de réaction Qr défini à un instant t de son évolution, par :
Ce quotient de réaction est sans unité. Les nombres qui correspondent à [A] ou [B] sont les mêmes
nombres que les concentrations molaires (exprimées en mol.L-1) des entités chimiques A ou B sauf que
ces nombres sont sans dimension. De plus, on admettra que le solvant (eau) et les corps solides
n'interviennent pas dans le quotient de réaction. ( [H2O] = 1 et [entité]s = 1).
A l’équilibre : Qréq = K
Lorsqu'un système chimique atteint son état d'équilibre (les concentrations en réactifs et produits
n'évoluant plus), son quotient de réaction Qréq se calcule en prenant les concentrations obtenues à
l’équilibre. Cette valeur, indépendante de la composition initiale, est appelée la constante d’équilibre,
notée K associée à l’équation de la réaction considérée. Comme K = Qréq , cette constante est donc
également sans unité. Elle n'est fonction que de la température.

Guibal Bellevue TS ch : 3. Sens spontané d’évolution est-il prévisible? (pile et électrolyse) 2/6
1- 2 Critère d’évolution spontanée
Une transformation est dite spontanée si elle a lieu « naturellement » ou « toute seule » (en
opposition à « forcée »). Ceci ne donne aucune information sur la cinétique de la réaction.
Un système chimique évolue spontanément, comme tout système (ressort étiré qui revient à sa longueur
initiale …), vers l’état d’équilibre. Ainsi, si un système chimique donné est à un instant t caractérisé par
une valeur Qr différente de K, alors, le système évoluera de façon à ce que son Qr tende vers K.
1- 3 Comment prévoir le sens d’évolution spontanée d’un système chimique ?
Afin de prévoir le sens d’évolution spontanée d’un système chimique, il suffit de comparer le quotient de
réaction Qr avec la constante d’équilibre K. Trois situations sont possibles :
Si Qr = K
L’état d’équilibre est déjà atteint. Macroscopiquement, le système n’évolue plus. N’oublions pas qu’en
réalité la vitesse dans un sens est « compensée » par la vitesse dans l’autre sens.
Si Qr < K
Le système évolue dans le sens direct : sens (1). En effet, Qr doit augmenter. Pour cela, les termes du
numérateur (les produits) doivent augmenter et les termes du dénominateur (les réactifs) doivent diminuer.
Ceci implique la consommation des réactifs au profit de la fabrication des produits, donc le sens direct.
Si Qr > K
La situation est exactement l’inverse de la précédente. Le système évolue dans le sens indirect : sens (2).
1
a A(aq) + b B(aq) c C(aq) + d D(aq)
2
Qr < K Qr > K
sens direct : sens 1 K sens indirect : sens 2
1- 4 Application à une réaction acido-basique
Toute réaction acido-basique est caractérisée par une constante K qui peut être calculée à partir des
différents KA ou Ke. Ainsi, pour un mélange donné fabriqué à l’instant t=0 (Etat Initial), il suffira de
calculer le quotient de réaction initial : QRi et de le comparer à K pour savoir quel sera le sens spontané de
la réaction. Application à une solution tampon ([acide] = [sa base conjuguée]) qui présente la particularité
de conserver un pH constant malgré un léger ajout d’acide ou de base.
1- 5 Application à une réaction d’oxydo-réduction : Autour d'une transformation dans le
domaine de l'oxydoréduction - Polynesie 2003 diaporama de correction(.pps)
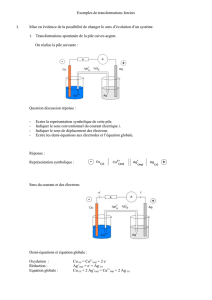
Étude d'une réaction d'oxydoréduction lorsque les deux réactifs sont directement en contact.
Un bécher contient un volume V1 = 20 mL de solution de nitrate d'argent de concentration
C1 = 1,0.10-1 mol.L-1 auquel on ajoute V2 = 20 mL de solution de nitrate de cuivre de concentration
C2 = 5,0.10-2 mol.L-1.
On obtient une solution dans laquelle coexistent les ions Ag+ , Cu2+ et NO3– .
On plonge ensuite dans le bécher un fil de cuivre et un fil d'argent bien décapés.
On observe une couleur bleue plus intense et un dépôt d’argent sur le fil de cuivre.
On donne 2 Ag+(aq) + Cu(s) = 2 Ag(s) + Cu2+(aq) ( K = 2,2.1015 )
Après avoir calculé les concentrations initiales des [Ag+]i et [Cu2+]i dans le becher, quel est le
sens spontané ? Est-ce cohérent avec les observations ?

Guibal Bellevue TS ch : 3. Sens spontané d’évolution est-il prévisible? (pile et électrolyse) 3/6
2- Des TRANSFORMATIONS SPONTANEES : les PILES
Une pile électrochimique est un générateur qui transforme de l'énergie chimique issue d'une réaction
d'oxydoréduction spontanée en énergie électrique. Une partie est perdue en chaleur (effet Joule). Le
courant électrique est dû au transfert spontané d’électrons, via un fil électrique, entre les espèces
chimiques de deux couples oxydant / réducteur.
2- 1 Les différentes parties de la pile
Deux électrodes constituées de matériaux conducteurs (des métaux ou du carbone).
Une ou plusieurs solutions électrolytiques
Une paroi poreuse ou un pont salin contenant des espèces ioniques. Son rôle est de fermer le
circuit afin de permettre le passage du courant dans la pile. Le contact électrique entre les deux
solutions est ainsi assuré sans que les solutions se mélangent. Le pont salin assure également la
neutralité électrique des solutions.
2- 2 Fonctionnement : une pile est un système chimique hors équilibre.
Lorsque la pile fonctionne, elle évolue en respectant le critère de l’évolution spontanée. La pile évolue
vers l’état d’équilibre. La valeur du quotient de réaction ( QR ) tend vers celle de la constante d’équilibre
( K) associée à l’équation de la réaction de fonctionnement de la pile.
La pile est usée lorsque l’état d’équilibre est atteint.
A l’anode : il se produit l'oxydation du métal le plus réducteur
(souvent le zinc). Il est noté ici : réducteur 1. L’anode est la
borne négative. Ce dernier s'oxyde et libère des électrons.
Nous retiendrons oxydation anodique
Red1 = Ox1 + n1 e- (multiplier par n2)
A la cathode : ( borne +) il se produit la réduction de l'oxydant 2
Ox2 + n2 e- = Red2 (multiplier par n1)
Le bilan électrochimique est alors : (pas d'électrons dans ce bilan)
n2 Red1 + n1 Ox2 n2 Ox1 + n1 Red2
Exemple : la pile Daniell : la pile cuivre – zinc
diaporama du fonctionnement de cette pile : la pile Daniell.ppt
L’équation de fonctionnement de cette pile s’écrit :
Zn (s) + Cu2+ (aq) = Zn2+ (aq) + Cu (s)
Pendant son fonctionnement “normal”, la pile se décharge pour apporter
de l’énergie aux récepteurs reliés. Elle respecte le critère de l’évolution spontanée. On peut observer la
diminution de l’anode en zinc (masse inférieure à l’état final). En revanche la cathode « grossit ». Il se
forme un dépôt de cuivre sur l’électrode en cuivre. La concentration en ion cuivrique Cu2+(aq) diminue.
Ceci se traduit par une décoloration progressive de la solution. (Ce sont les ions Cu2+ (aq) qui sont à
l’origine de la couleur bleue)
2- 3 Représentation formelle d’une pile
La représentation formelle de la pile est obtenue en plaçant la borne négative (donc l’anode) à gauche et
en indiquant les espèces chimiques rencontrées dans la pile en commençant chaque couple redox par le
réactif. Le pont salin est représenté par une double barre. La pile Daniell est donc représentée par :
- Zn / Zn2+ // Cu2+ / Cu + .

Guibal Bellevue TS ch : 3. Sens spontané d’évolution est-il prévisible? (pile et électrolyse) 4/6
2- 4 Mouvement des porteurs de charges : lorsque la pile débite, les porteurs de charges sont:
Dans le circuit extérieur à la pile : ce sont des électrons qui circulent dans les fils et dans
les conducteurs de la borne négative vers la borne positive : sens opposé au sens
conventionnel du courant ( I va de la borne positive vers la borne négative).
Dans le pont salin et dans les solutions : ce sont des ions qui se déplacent. Le mouvement
des ions dans le pont salin est tel que les solutions restent électriquement neutre. Dans la
demi-pile qui s'enrichit en cations (électrode négative) le pont salin apporte des anions et
dans la demi-pile qui s'appauvrit en cations (électrode positive) le pont salin apporte des
cations.
2- 5 Force électromotrice E et résistance interne r d’une pile
La caractéristique intensité tension d'une pile est donnée ci-contre.
Son équation est: UPN = E - r I
E est appelée force électromotrice (f.e.m) de la pile. Elle se mesure en volt. C'est la tension
aux bornes de la pile lorsqu'elle ne débite pas (tension à vide). Pour la mesurer il suffit de
brancher un voltmètre aux bornes de la pile lorsqu'elle n'est pas reliée à un circuit.
E est alors égale à la valeur absolue de la valeur affichée par le voltmètre.
La f.e.m d’une pile ne dépend ni de sa forme, ni de ses dimensions, ni de la nature du pont
salin. En revanche, elle dépend de la nature des couples redox (potentiel standard E°) et
des concentrations des espèces qui interviennent.
r est la résistance interne de la pile. Elle se mesure en ohm ( Ω ). Elle est numériquement
égale à l'opposé du coefficient directeur de la caractéristique intensité-tension.
ICC est le courant de court-circuit.
2- 6 Quantité d'électricité maximale Qmax ( en coulomb) débitée par la pile :
capacité en charge de la pile :
La quantité maximale d’électricité fournie par une pile dépend de la quantité de matière du réactif limitant.
Si l'on suppose que l'intensité (en ampère) du courant débité est constante, alors: Qmax = I x Δtmax
avec Δtmax : la durée de fonctionnement en seconde.
La quantité d’électricité portée par une mole d’électrons est appelé le faraday. Il est noté F ou F et vaut
F = NA x e = 6,02 . 10 23 x 1,6 . 10 -19 = 96 500 C.mol-1.
Si l’équation de fonctionnement d’une pile fait intervenir n électrons alors une mole de réducteur fournit
ne- moles d'électrons , alors la quantité d’électricité maximale
fournie par la pile pendant la durée Δtmax , est aussi : Qmax = ne- F = n xmax F
Remarque : La quantité d’électricité peut être exprimée en ampère heure (Ah).
Comme Q = I.Δt , la correspondance est : 1 Ah = 3 600 C

Guibal Bellevue TS ch : 3. Sens spontané d’évolution est-il prévisible? (pile et électrolyse) 5/6
3- Une TRANSFORMATION FORCEE : l ’ électrolyse
3- 1 Comment « forcer » une réaction ?
Pour aller « contre » le sens spontané, il faut apporter de l’énergie au système. Ainsi, il suffit de
placer correctement un générateur. L’énergie apportée sera sous forme électrique. Le passage du courant
dans un électrolyte (liquide contenant des ions) s’accompagne d’une transformation forcée : c’est une
électrolyse qui permet de réaliser la transformation inverse de celle qui se passe dans une pile.
Au cours de cette transformation, le QR s’éloignera de la constante d’équilibre K.
3- 2 Expérience n°1 : électrolyse d’une solution de bromure de cuivre
Le symbole du générateur barré d'une flèche représente un générateur de tension continue réglable.
Lorsque la tension appliquée est trop faible ( < 1,2 V ) il ne se passe rien. Pour une tension appliquée
supérieure à 1,2V, on observe un dépôt de cuivre sur l'électrode négative (cathode) et l'apparition de
dibrome en solution au voisinage de l'électrode positive (anode).
A la cathode négative : Cu2+ (aq) + 2e- = Cu(s) , gain d'électrons, c'est une réduction.
A l'anode positive : 2 Br- (aq) = Br2 + 2 e- , perte d'électrons c'est une oxydation.
Bilan : Cu2+(aq) + 2 Br -(aq) Cu(s) + Br2 Ce bilan est l'inverse de celui
correspondant à l'évolution spontanée.
Cette transformation forcée est appelée électrolyse.
3- 3 Anode et cathode
Anode : l'électrode à laquelle se produit une
oxydation est appelée anode
(électrode par laquelle le courant arrive dans
l'électrolyseur est l’anode)
A l’anode, des électrons partent dans le circuit
extérieur. Ces électrons sont fournis par un
réducteur de l’électrolyseur, qui subit alors une
oxydation ( il perd des électrons). Selon le cas, il
peut y avoir :
Oxydation de l’électrode
Oxydation d’un ion présent dans la
solution
Oxydation de l’eau ( en dioxygène )
Cathode : l'électrode à laquelle se produit
une réduction est appelée cathode
(électrode par laquelle le courant sort de
l'électrolyseur)
A la cathode, des électrons sont apportés par le
circuit extérieur. Ces électrons sont captés par un
oxydant présent dans l’électrolyseur, qui subit
alors une réduction ( il gagne des électrons).
Selon le cas, il peut y avoir :
Réduction de l’électrode
Réduction d’un ion présent dans la
solution
Réduction de l’eau ( en dihydrogène )
Le bilan électrique global correspond à un transfert d’électrons de l’anode vers la cathode par l’extérieur.
 6
6
1
/
6
100%