Recombinaison génétique : mécanismes et rôles biologiques Cours

Recombinaison génétique : mécanismes et rôles biologiques
Cours du 3 octobre 2008 : AN1
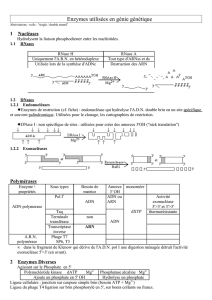
Diversité des lésions de l'ADN.
Tous les événements de recombinaison sont dus à des lésions de l'ADN.
Les lésions peuvent être :
- endogène : lisier à la réplication. L'ADN polymérase arrête son processus et considère
cela comme un dommage.
- Exogène : radiation ultraviolette, radiations induites par des rayons ionisants.
La réparation peut avoir 2 conséquences :
- réparation fidèle : recherche d'un chromosome homologue pour réparer. C'est le cas
chez les cellules diploïdes ou en phase S/G2. Chez les génomes haploïdes de bases, leurs
génomes sont potentiellement redondants. Cette région dupliquée peut servir de
matrices pour réparer.
- Recombinaisons illégitimes.
Ces mutations ont aussi un avantage évolutif. Elles induisent la diversité génétique de l'espèce. Les
lésions peuvent être de type double brin, simple brin, lésions chimiques (modification de bases...)
Le nombre de mutations par génomes cellulaires est bas.
Chez l'homme le génome comporte environ 4 milliards de nucléotides avec une fréquence de
mutations de quatre mutations /cellule pour un total de 10E13 cellules dans l'organisme. La structure
double brin de l'ADN est déjà une solution en soi aux ruptures simples brins et aux modifications
chimiques. Tous les types de lésions sont potentiellement est arabes. Les dommages à l'ADN sont
détectés et il y a la possibilité d'arrêter le cycle cellulaire.
Dans beaucoup de situation, l'ADN et de structures simples brins et en structure branchée (cf
diapositive).
RPA peut non seulement jouer un rôle de protection mais aussi de signalisation des dommages.
Voies de réparation des cassures double brin (DSBs).
- On essaie de mettre les deux bouts des chromosomes qui ont été séparés l'un avec
l'autre : jonction des extrémités non homologues : entraîne un effet mutagène (NHEJ].
- Recombinaisons homologues.
Le choix entre ces deux voies dépend de l'érosion simple :
- Pour NHEJ : l'érosion sera courte, de quelques nucléotides. Pas de recrutement des
protéines RPA.
- Pour la recombinaison homologue (RH), la dégradation sera plus grande.
L'érosion joue un rôle décisif sur la voie de réparation.
Chez l'homme on compte environ 20 000 interruptions de l'ADN, 5000 lésions de type alkylantes…
T-loop : comment la cellule identifiée de ce simple brin comme un problème et non pas comme un
phénomène normal ?
La cellule à inventer 2 stratégies :

- on met des protéines spécifiques dans cette région.
- Stratégie ADN-ADN : l'extrémité simple brin fait une boucle et envahie une molécule double
brin qui a une complémentarité de séquence qui donnera une structure branchée et qui sera
stabilisée par des protéines.
Voies de réparation au cours de la réplication :
- soit dans la situation non dupliquée : cas du NHEJ mutagène.
- Choix après le passage de la fourche de réplication : la matrice est présente dans la zone
avoisinante donc le système utilisera la voie de réparation par recombinaison homologue
de façon fidèle (RH)
Réparation des DSBs parend-joining.
Chez la levure, Scku 70 et 80 se fixent sur les extrémités et recrutent le trimère ScRad 50
/Mre 11/ Xrs2 qui font nettoyer les extrémités puis intervention des ligases ScLig4/lif1.
Il y a des situations plus ou moins favorables pour l'action de la ligase et le recollement des deux
brins.
HR versus NHEJ.
Au regard de la sensibilité aux ultraviolets et on regarde le taux de cellules qui survivent.
ku 70Δ et Lig4Δ sont presque comme le WT car les cellules doivent utiliser la voie alternative (elle se
dirigent vers le système de réparation RH au lieu du système NHEJ).
Sensibilité aux rayons γ :
Les mutants Rad 52 (voie de RH) sont très sensibles.
Les doubles mutants (donc muter sur les deux voies) sont encore plus sensibles.
Exemple de recombinaison homologue.
Cf diapositive.
Mécanismes de réparation par recombinaison.
On couple plasmide car les extrémités des chromosomes sont extrêmement réactives. Il y a
une copie du site ABCD après la recombinaison.
Produit de la recombinaison.
- Crossing-over : échange réciproque sur deux molécules d'ADN.
- Conversion génique : un souvent d'un brin est inséré sur un autre brin.
- Transposition.
Méiose et transposition chez Saccaromices cerevisae.
Au cours de la formation des cellules germinales, la diversité va être créée. La recombinaison
a lieu pendant la méiose, qui a aussi pour but de réduire le nombre de chromosomes de moitié.
Première étape : réplication de l'ADN : 2n => 4n.
Prophase de méiose : recombinaison entre les chromosomes homologues.
Première division de méiose : les deux chromosomes homologues qui se sont répliqués se séparent à
chaque pôle de la cellule.

Il n'y a pas d'autre réplication mais met immédiatement arrive la deuxième étape de division. Quatre
cellules haploïdes sont ainsi créées.
Identification des événements de reconversion génique et de crossing-over.
- Absence de recombinaison : identique aux parents.
- Crossing-over : échange entre chromatines non sœurs.
- Conversion génique : une spore qui a subi la conversion : une partie d'un brin parental
s'est inséré.
- Conversion génique couplée à un crossing-over.
Stimulation de la recombinaison homologue.
₊ : gène pour l’Arg : moyen de sélection.
Les cellules ayant fait des recombinaisons pousseront sur un milieu sans Arg.
A t=0 : peu de recombinaison dans les cellules somatiques avant la méiose.
Cinq heures plus tard : 400 fois plus de produits recombinants pendant la méiose dans une phase
entre la réplication et la division.
La région 5’ du gène Arg4 et un point chaud de recombinaison méiotique.
Le point chaud est dans la région intergénique, en amont du gène Arg4.
Ont induit la méiose chez une population cellulaire, on prélève à différents temps, on extrait d'ADN.
On regarde les résultats sur un Southern-Blot.
Au bout de six heures, on remarque des fragments plus petits qui visualisent que l'on a eu une
cassure double brin de l'ADN dans la région intergénique en amont du gène Arg4.
Au cours de la méiose dans cette région, il y a une cassure double brin. Puis après, la cassure
est réparée ce qui explique la disparition de la bande.
Multiplicity and Distribution of Spo11 dependant meiotic DSBs.
Gel de gauche : Utilisation de gels dénaturants et hyper-résolutifs pour la migration.
Troisième gel à partir de la gauche : électrophorèse en champ pulsé : on sépare les
chromosomes les uns des autres.
Deuxième gel à partir de la gauche : Southern-Blot classique.
Gel de droite : puce à ADN : on détermine l'ensemble des DSBs.
Méthode de cartographie des DSBs.
Spo11 : nucléase qui s'occupe des coupures double brin.
On couple avec des enzymes de restrictions, et on fait migrer sur un gel dénaturant. On utilise une
sonde simple brin complémentaire de la séquence spécifique à chaque brin. On cartographie ainsi les
sites de coupures.
Chaque bande correspond à un type de coupures.
Chaque barre sur la séquence correspond à un site de coupures et sa longueur indique la fréquence
de coupures.
La recombinaison est engagée dans des régions spécifiques ayant des sites de coupures
spécifiques (pas de séquence consensus).
1
/
3
100%