TP 2 : Mise en évidence de la séropositivité au VIH

TP 4 : DM Evolution du phénotype immunitaire
Partie 1 : Vaccination et sérothérapie
Situation : Bruno vient de se couper profondément avec un clou rouillé. Il ne se souvient plus la date à laquelle il a été vacciné
contre le tétanos. Il vient consulter son généraliste car il est inquiet.
Vous êtes son docteur et vous procédez alors à une double injection, d’un sérum et d’un vaccin avec adjuvant.
Objectif : A partir de l’analyse de l’ensemble des documents, vous devez justifier cette double injection.
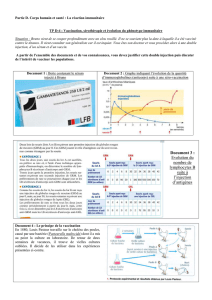
Document 1 : Boite contenant le sérum
injecté à Bruno
Document 2 : Graphe indiquant l’évolution de la quantité
d’immunoglobulines (anticorps) suite à une séro-vaccination
Document 3 :
Evolution du
nombre de
lymphocytes B
suite à
l’injection
d’antigènes
Document 4 : Le principe de la vaccination
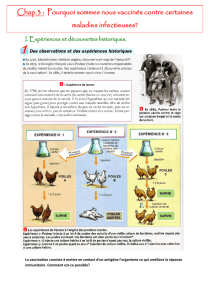
En 1880, Louis Pasteur travaille sur le choléra des poules,
causé par une bactérie (Pasteurella multocida) dont il a
mis au point la culture en laboratoire. De retour de deux
semaines de vacances, il trouve de vielles cultures
oubliées. Il décide de les utiliser dans les expériences
présentées ci-contre.

Document 5 : les adjuvants des vaccins
Bien souvent, on ajoute des adjuvants aux vaccins. Ce sont des composés variés qui ont un point commun : ils renforcent la
réponse de l’organisme à l’antigène injecté par vaccination mais ces molécules en elles-mêmes ne sont pas des antigènes de
la maladie contre laquelle on réalise la vaccination. Un des plus fréquents est un adjuvant composé de squalène (substance
que l’on trouve à l’état naturel dans les plantes, chez l’animal et chez l’homme. Commercialement il est extrait de l’huile de
poisson, particulièrement de l’huile de foie de requin. Purifié il est ensuite ajouté dans des vaccins ou des produits
pharmaceutiques). C’est celui à base de squalène qui serait le plus utilisé en Europe (Novartis l’utilise sous l’appellation
MF59). Il y a aussi l’adjuvant ASO3 utilisé par le laboratoire GSK (composé d’un mélange de Vitamine E, de polysorbate et de
squalène) qui n’a jamais été utilisé dans un vaccin administré à si grande échelle. On utilise également souvent l’aluminium
ou l’alun, particulièrement contre les virus grippaux : les sels d'aluminium ont démontré leur efficacité en permettant de
réduire jusqu'à huit fois la dose vaccinale nécessaire à l'induction d'un taux d'anticorps similaire à celui obtenu avec la dose
commune (15 microgrammes d'hémagglutinine par souche virale).
Un certain nombre d’autres adjuvants immunologiques font l'objet d'études expérimentales pour leur inclusion dans les
vaccins antigrippaux. Une classe potentiellement intéressante d'adjuvants est représentée par les entérotoxines bactériennes
sous forme détoxifiée : la toxine de Vibrio cholerae et la toxine thermolabile de Escherichia coli. Il a été démontré que
l'adjonction d'une de ces toxines à un antigène conduit à une forte réponse immune contre cet antigène. Ces molécules ont
un grand intérêt dans le cadre d'une administration locale, par voie nasale : où elles induisent une sécrétion importante
systémique et locale d'IgG et d'IgA. Leur utilisation par voie nasale réduit de beaucoup leur toxicité pour le tractus digestif.
Document 6 : les adjuvants remis en question.
http://sante.lefigaro.fr/actualite/2013/08/07/21103-vaccins-laluminium-declares-sans-danger
http://www.who.int/vaccine_safety/committee/topics/adjuvants/squalene/questions_and_answers/fr/
Partie 2 : Evolution du phénotype immunitaire
Objectif : montrer que l’immunité adaptative évolue au cours d’une vie, d’une personne à l’autre, d’un lieu à un autre et
que cette extrême variabilité assure la stabilité des organismes (le maintien de leur intégrité).
Matériel : livre (p 310-311), ordinateur avec connexion à Internet.
Sur le site http://svtmaupassant.wordpress.com vous trouverez différents dossiers dont:
Phénotype_immunitaire.pdf (document présentant l’évolution du phénotype immunitaire et son adaptation au monde
pathogène)
Aide à la résolution : à l’aide des différentes ressources à votre disposition, décrivez l’évolution du phénotype immunitaire au cours d’une vie et montrez
que cette évolution, couplée à une campagne de vaccination, peut conférer une protection à l’échelle d’un individu, ou même d’une population. Recherchez
des maladies éradiquées de la surface du Globe grâce à la vaccination.

Correction TP 4 partie 1
Doc 1 : Le sérum contient des immunoglobulines tétaniques c'est-à-dire des anticorps spécifiques contre
les Ag tétaniques.
L´injection d´Ig va permettre de traiter rapidement contre une infection bactérienne du tétanos.
Dans graphe du doc 2, on distingue les anticorps (immunoglobulines) injectés (courbe bleue) des
anticorps fabriqués par l’individu suite à une injection de vaccin (anatoxine tétanique).
Le taux plasmatique des immunoglobulines injectées augmente brutalement et rapidement ( 0,5 dans
les 1ers j suivant l’injection) suite à l’injection (normal !) mais décroît ensuite régulièrement pour
devenir nul au bout de 8 semaines.
Durant la première semaine suivant l’injection de vaccin, le taux d’anticorps antitétaniques
n’augmente pas. En revanche, celui-ci va augmenter pour atteindre la zone de protection au bout de
deux semaines : c’est justement le moment où la protection assurée par les immunoglobulines injectées
va disparaître.
L’injection d’immunoglobulines (sérothérapie) assure une protection rapide et immédiate contre le
tétanos, mais cette protection est de courte durée.
En revanche, la protection assurée par le vaccin n’est pas immédiate mais retardée, mais elle va être de
longue durée, d’autant plus que l’on réalisera des injections de rappel du vaccin (à 4 et 8 semaines).
L’intérêt de la combinaison de ces deux procédés est alors évident.
Doc 3 :
L’expérience 1 met en évidence l’existence d’une mémoire immunitaire car le nombre de LB augmente
beaucoup plus vite lors de la deuxième injection de GRM que lors de la première injection.
L’expérience 2 permet de préciser que cette mémoire est spécifique. Les souris du lot B ont
développé une réponse primaire contre les GRM, mais cela ne les a en rien « préparées » à une réponse
lors de l’injection de GRL : en effet, après l’injection de GRL au jour 30, les souris du lot B développent
une réponse primaire vis-à-vis des GRL tout à fait comparable quantitativement à la réponse primaire
des souris du lot A vis-à-vis des GRM, du jour zéro au jour 30.
Doc 4 :
1
/
3
100%